Er kogepunkter af alle væsker de samme?
Her er hvorfor:
* Intermolekylære kræfter: Styrken af de attraktive kræfter mellem molekyler (som hydrogenbinding, dipol-dipolinteraktioner og London-spredningskræfter) spiller en vigtig rolle i bestemmelsen af kogepunktet. Stærkere kræfter kræver mere energi for at bryde fra hinanden, hvilket resulterer i højere kogepunkter.
* molekylær størrelse og form: Større molekyler med mere overfladeareal har stærkere London -spredningskræfter, hvilket fører til højere kogepunkter.
* tryk: Kogepunktet påvirkes også af trykket omkring væsken. Lavere tryk betyder et lavere kogepunkt.
Eksempler:
* Vand (H₂O) koger ved 100 ° C (212 ° F) ved standard atmosfærisk tryk.
* Ethanol (C₂H₅OH) koger ved 78,37 ° C (173 ° F) ved standard atmosfærisk tryk.
* Kviksølv (HG) koger ved 356,73 ° C (674,11 ° F) ved standard atmosfærisk tryk.
Som du kan se, er kogepunkterne for disse almindelige væsker ganske forskellige på grund af variationer i deres molekylstruktur og intermolekylære kræfter.
Sidste artikelHvilket stof vil sandsynligvis ikke kvantitativt følge Henry Law opløst i vand?
Næste artikelEr P3- et atommolekyle eller ion?
 Varme artikler
Varme artikler
-
 Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo
Udstiller moderne falsknereRobert Trotter smedede Sarah Honns billede af 1866 først i anden halvdel af det 20. århundrede. Kredit:James Hamm, Buffalo State College, State University of New York, Bøffel, NY Kunstmarkedet boo -
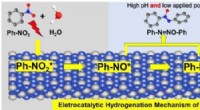 Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly
Hydrogeneringsregulering af nitrobenzen i elektrokatalytiske processer realiseretGrafisk abstrakt. En omfattende forståelse af selektiviteten over for elektrokatalytiske hydrogeneringsprodukter af nitrobenzen blev udført eksperimentelt og teoretisk over en Cu3Pt/C -legeringskataly -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig -
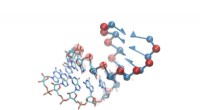 Opdagelse af strukturen af RNAEn ny undersøgelse udvikler en innovativ simuleringsmodel, der effektivt kan forudsige konformationen af ribonukleinsyremolekyler, åbne op for interessante muligheder for ansøgning og forskning Kred
Opdagelse af strukturen af RNAEn ny undersøgelse udvikler en innovativ simuleringsmodel, der effektivt kan forudsige konformationen af ribonukleinsyremolekyler, åbne op for interessante muligheder for ansøgning og forskning Kred
- Hvordan dræber varme? Det forvirrer din hjerne. lukker organer ned. overanstrenger hjertet.
- Grønt lys til ultrafine displayfarver
- Kan du føle luft, når du bevæger dine hænder virkelig hurtigt?
- Løgne er mere almindelige på bærbare computere end telefoner:Hvordan enheder former vores adfærd…
- En blanding med mere end en synlig fase?
- Er h2so4 en ionforbindelse eller en molekylær forbindelse?


