Hvordan påvirker tilstedeværelsen af dobbelt-ioniseret ilt kemiske reaktioner i et givet system?
1. Dannelse af O 2+ :
* Krav med høj energi: Fjernelse af to elektroner fra et iltatom kræver en betydelig mængde energi. Dette forekommer normalt i ekstremt højenergimiljøer som:
* plasma: En meget ioniseret gas med frie elektroner og ioner.
* stjerner og stjernernes atmosfærer: De intense varme- og trykstrimmelelektroner fra atomer.
* højenergi-stråling: Stråling kan tilvejebringe den nødvendige energi til ionisere ilt.
* ustabil under de fleste forhold: Under normale forhold er O 2+ er meget reaktiv og ustabil. Det får let elektroner til at danne mindre ioniserede tilstande, såsom O + eller neutralt ilt (O).
2. Kemisk reaktivitet af O 2+ :
* stærk oxidation: På grund af sin høje positive ladning, O 2+ er et potent oxiderende middel. Det reagerer let med andre arter, forsøger at vinde elektroner og blive mere stabile.
* kan katalysere reaktioner: I nogle tilfælde o 2+ Kan fungere som en katalysator og fremskynde reaktioner ved at tilvejebringe en alternativ reaktionsvej.
3. Påvirkning på kemiske systemer:
* i plasmakemi: O 2+ spiller en nøglerolle i forskellige plasmaprocesser, herunder:
* Plasma -ætsning: Brugt i halvlederfremstilling til ætsningsmaterialer.
* plasmapolymerisation: Oprettelse af tynde film med unikke egenskaber.
* plasmamedicin: Udvikling af nye behandlinger til forskellige medicinske tilstande.
* i astrofysik: O 2+ er til stede i stjernernes atmosfærer og bidrager til den kemiske sammensætning og energibalance for stjerner.
* i laboratorieundersøgelser: O 2+ studeres i laboratorieeksperimenter under kontrollerede forhold for at forstå dens rolle i forskellige kemiske reaktioner.
Samlet set, mens dobbelt-ioniseret ilt er en meget reaktiv art, findes den typisk i ekstreme miljøer. Dets tilstedeværelse i et givet system ville ændre de kemiske reaktioner markant, ofte fungerer som en stærk oxidation og potentielt påvirke reaktionshastigheden eller vejen.
Sidste artikelHvad bruges emissionsspektrografen til?
Næste artikelHvilke 2 gasser består af gasgiganterne af?
 Varme artikler
Varme artikler
-
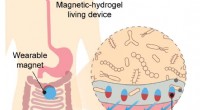 Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe
Levende sensorer undersøger tarmens mysterierSkematisk illustration af brugen af levende sensorer indkapslet i en magnetisk hydrogelanordning til undersøgelser af tarmen. Kredit:Xinyue Liu et al Forskning i den menneskelige tarm og mikrobe -
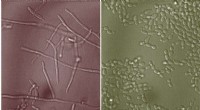 Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form
Molekyler fundet i slim kan modvirke svampeinfektionDen mere smitsomme form for gæren Candida albicans er en lang filament (til venstre). MIT-forskere har vist, at når gæren dyrkes i nærværelse af mucinglykaner, forbliver den i sin runde, harmløse form -
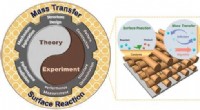 3D-ordnet kanal forbedrer elektrokatalyseGrafisk abstrakt. Kredit:DOI:10.1021/jacs.1c04653 Et team ledet af prof. YU Shuhong og prof. HOU Zhonghuai fra University of Science and Technology of China (USTC) fra det kinesiske videnskabsakad
3D-ordnet kanal forbedrer elektrokatalyseGrafisk abstrakt. Kredit:DOI:10.1021/jacs.1c04653 Et team ledet af prof. YU Shuhong og prof. HOU Zhonghuai fra University of Science and Technology of China (USTC) fra det kinesiske videnskabsakad -
 Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ
Opdagelse af afgiftningsenzym kunne bruges til at målrette mod større afgrødeforurenende stofferKredit:CC0 Public Domain Planter har udviklet afgiftningsforsvarssystemer som beskyttelse mod en række miljømæssige eller patogenproducerede forurenende stoffer. Sammenlignet med enzymer af primæ
- Hvad er en videnskabelig forbindelse?
- Guld nanorods retter sig mod kræftceller
- Nye målinger til vejledning af strålebehandling
- Hvorfor varme og arbejde er vejfunktion bevist?
- Discovery afslører, hvordan planter laver cellulose for styrke og vækst
- Billede af flere bølgelængder af tandbørste galaksehoben


