Hvad er forskellen mellem ammoniumhydroxid og kaliumhydroxid?
1. Kemisk formel:
* ammoniumhydroxid: NH 4 Åh (i løsning)
* kaliumhydroxid: Koh
2. Sammensætning:
* ammoniumhydroxid: Det er en løsning af ammoniak (NH 3 ) opløst i vand. Ammoniak fungerer som en svag base, og når det opløses i vand, reagerer den med vand for at danne ammoniumioner (NH 4 + ) og hydroxidioner (OH - ).
* kaliumhydroxid: Det er en solid forbindelse, der består af kaliumioner (K + ) og hydroxidioner (OH - ).
3. Styrke:
* ammoniumhydroxid: Det er en svag base, hvilket betyder, at den ikke helt adskiller sig i ioner i opløsning.
* kaliumhydroxid: Det er en stærk base, hvilket betyder, at den fuldstændigt adskiller sig i ioner i opløsning.
4. Egenskaber:
* ammoniumhydroxid: Det har en skarp, ammoniaklignende lugt og er en klar, farveløs løsning. Det bruges ofte som rengøringsmiddel og i syntesen af andre kemikalier.
* kaliumhydroxid: Det er et hvidt fast stof, der er meget opløseligt i vand. Det er ætsende og kan forårsage alvorlige forbrændinger ved kontakt med hud eller øjne. Det bruges til fremstilling af sæbe, batterier og andre kemikalier.
5. Ansøgninger:
* ammoniumhydroxid: Det bruges i rengøringsmidler, som et reagens i kemisk syntese og i gødning.
* kaliumhydroxid: Det bruges til produktion af sæbe, batterier, gødning og til fremstilling af forskellige kemikalier.
Sammendrag:
| Funktion | Ammoniumhydroxid | Kaliumhydroxid |
| ---------------- | -------------------- | ---------------------- |
| Formel | NH 4 Åh (løsning) | Koh |
| Styrke | Svag base | Stærk base |
| Tilstand | Løsning | Solid |
| Korrosivitet | Mindre ætsende | Meget korrosiv |
| Applikationer | Rengøring, syntese | Sæbe, batterier |
I det væsentlige er ammoniumhydroxid en svagere base, der er mindre ætsende og har et mere begrænset interval af anvendelser end kaliumhydroxid.
 Varme artikler
Varme artikler
-
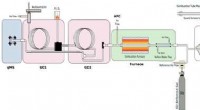 At snuse til rigtige trøflerKredit:American Chemical Society For en pris på tusinder af dollars pr. trøfler er en dyr mad. Svampene er værdsat for deres karakteristiske aroma, og mange fødevarer hævder trøfler eller deres ar
At snuse til rigtige trøflerKredit:American Chemical Society For en pris på tusinder af dollars pr. trøfler er en dyr mad. Svampene er værdsat for deres karakteristiske aroma, og mange fødevarer hævder trøfler eller deres ar -
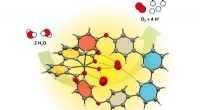 Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg
Kunstigt enzym opdeler vand mere effektivtEnzymlignende vandfororganisering foran en Ruthenium-vandoxidationskatalysator. Kredit:Würthner-gruppen / Würzburg Universitet Menneskeheden står over for en central udfordring:Den skal klare overg -
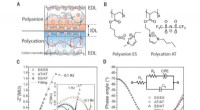 Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in
Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in -
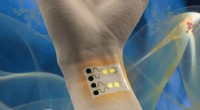 En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
En bærbar gassensor til sundheds- og miljøovervågningEn bærbar gassensor kan overvåge miljømæssige og medicinske forhold. Kredit:Cheng Lab/Penn State En meget følsom, Bærbar gassensor til miljø- og sundhedsovervågning kan snart blive kommercielt til
- Donutbjælker hjælper fysikere med at se utroligt små genstande
- Body Parts of a Seagull
- Den type elektronsky omkring kernen, der viser mulige positioner?
- Det sydlige Ocean tager varmen fra klimaændringer
- Eksponering for falske nyheder under det amerikanske valg i 2016 er blevet overvurderet:undersøgels…
- Lokaliserede excitoner i 2-D materialer til integreret kvanteoptik


