Kan du forklare, hvad der sker med partiklerne af kaliumchlorid, når de opløses i vand?
1. Ionisk karakter af kaliumchlorid:
* Kaliumchlorid er en ionisk forbindelse . Dette betyder, at det er dannet af den elektrostatiske tiltrækning mellem positivt ladede kaliumioner (K+) og negativt ladede chloridioner (Cl-).
2. Vands polaritet:
* Vand (H2O) er et polært molekyle . Dette betyder, at det har en lidt positiv ende (nær hydrogenatomerne) og en lidt negativ ende (nær iltatomet).
3. Opløsningsproces:
* attraktion: Når KCl tilsættes til vand, tiltrækkes de polære vandmolekyler af de ladede ioner af KCl.
* omgivende: De positive ender af vandmolekyler omgiver de negativt ladede chloridioner (Cl-), mens de negative ender af vandmolekyler omgiver de positivt ladede kaliumioner (K+).
* adskillelse: Denne attraktion svækker de elektrostatiske kræfter, der holder kalium- og chloridioner sammen i KCL -krystalgitteret.
* Hydrering: Vandmolekylerne "trækker" ionerne væk fra krystallen, omgiver dem og danner en hydratiseringsskal.
* dissociation: KCL -krystalen går i stykker fra hinanden, og de individuelle ioner bliver spredt over hele vandet.
Nøglepunkter:
* Ingen nye obligationer: Ionerne danner ikke nye kemiske bindinger med vandmolekylerne; De er simpelthen omgivet af dem.
* Løsning: Den resulterende blanding er en homogen opløsning , hvilket betyder, at ionerne er jævnt fordelt over vandet.
* elektrolytter: KCL-løsninger udfører elektricitet, fordi de frie bevægende ioner kan bære en elektrisk strøm.
Visualisering af det: Forestil dig KCL -krystallerne som små saltblokke. Når du tilsætter vand, fungerer vandmolekylerne sig mellem "blokke", trækker ionerne fra hinanden og holder dem omgivet.
Sidste artikelHvilken type binding har magnesium og nitrogen?
Næste artikelHvad er polariteten af tert-butylchlorid?
 Varme artikler
Varme artikler
-
 Biofunktionaliseret keramik til reparation af kranieknogledefekter - in vivo undersøgelseIllustration af de multifunktionelle materialer eksperimentelt udviklet i undersøgelsen til in vivo anvendelser af celleproliferation og kranioplastik. Defektheling i en gnavermodel observeres efter 1
Biofunktionaliseret keramik til reparation af kranieknogledefekter - in vivo undersøgelseIllustration af de multifunktionelle materialer eksperimentelt udviklet i undersøgelsen til in vivo anvendelser af celleproliferation og kranioplastik. Defektheling i en gnavermodel observeres efter 1 -
 Bæredygtig plast er i horisontenKredit:CC0 Public Domain En ny undersøgelse fra Tel Aviv University beskriver en proces til fremstilling af bioplastiske polymerer, der ikke kræver jord eller ferskvand - ressourcer, der er knappe
Bæredygtig plast er i horisontenKredit:CC0 Public Domain En ny undersøgelse fra Tel Aviv University beskriver en proces til fremstilling af bioplastiske polymerer, der ikke kræver jord eller ferskvand - ressourcer, der er knappe -
 Hjemmelavet mikroskop afslører, hvordan en kræftfremkaldende virus klæber til vores DNAM. Mitchell Smith, Ph.d., (til venstre) byggede lasermikroskopet, selvom hans baggrund er inden for molekylær genetik, ikke mikroskopbygning. Han er afbilledet sammen med samarbejdspartnere Margaret J
Hjemmelavet mikroskop afslører, hvordan en kræftfremkaldende virus klæber til vores DNAM. Mitchell Smith, Ph.d., (til venstre) byggede lasermikroskopet, selvom hans baggrund er inden for molekylær genetik, ikke mikroskopbygning. Han er afbilledet sammen med samarbejdspartnere Margaret J -
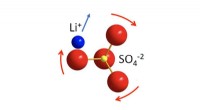 JCESR lægger grundlaget for mere sikker, batterier, der holder længerePaddlewheel -effekten. Over en bestemt temperatur, SÅ ?? ² anioner begynder at rotere, og samtidig i nærheden af Li? kationer bliver meget mobile. Linda Nazars arbejde viser, at i visse faste elektr
JCESR lægger grundlaget for mere sikker, batterier, der holder længerePaddlewheel -effekten. Over en bestemt temperatur, SÅ ?? ² anioner begynder at rotere, og samtidig i nærheden af Li? kationer bliver meget mobile. Linda Nazars arbejde viser, at i visse faste elektr
- Hvordan kan en længdeenhed blive volumen?
- Hvad Muon g-2-resultaterne betyder for, hvordan vi forstår universet
- Er det sandt, at en hul klippe foret med krystaller er geode?
- Er smartphone-teknologi fremtiden for amerikanske valg?
- Hvordan skriver du sytten hundrede tusindedele i standardform?
- Håndtering af forpligtede emissioner i både USA og Kina kræver kulstofopsamling og -lagring


