Hvorfor reagerer aluminium med tre bromatomer?
* Valenselektroner: Aluminium (AL) har tre valenselektroner i sin ydre skal, mens brom (BR) har syv. Aluminium ønsker at miste disse tre elektroner for at opnå en stabil oktetkonfiguration, mens brom ønsker at få et elektron for at opnå det samme.
* Elektrostatisk attraktion: Tabet af elektroner ved aluminium skaber en positivt ladet aluminiumion (al³⁺), mens brom får et elektron til dannelse af en negativt ladet bromidion (br⁻). Disse modsatte afgifter tiltrækker hinanden på grund af elektrostatiske kræfter.
* ionisk binding: Den stærke elektrostatiske attraktion mellem den positivt ladede aluminiumion og de negativt ladede bromidioner resulterer i dannelsen af en ionisk binding.
* stabilitet: Tre bromatomer er påkrævet for at afbalancere +3 ladning af aluminiumion, hvilket resulterer i dannelsen af aluminiumbromid (ALBR₃). Denne forbindelse er stabil på grund af de afbalancerede ladninger og oktetkonfigurationen opnået af alle involverede atomer.
I resuméet drives reaktionen mellem aluminium og brom drevet af begge elementers ønske om at opnå en stabil elektronkonfiguration. Dette fører til dannelsen af en ionisk forbindelse, aluminiumbromid (Albr₃), hvor tre bromatomer binder sig med et aluminiumatom.
 Varme artikler
Varme artikler
-
 Feedback fra tusindvis af designs kunne transformere proteinteknologiEn model af et beregningsmæssigt designet miniprotein fra en storstilet undersøgelse fra UW Medicine Institute for Protein Design. Kredit:UW Medicine Institute for Protein Design Scenen er sat til
Feedback fra tusindvis af designs kunne transformere proteinteknologiEn model af et beregningsmæssigt designet miniprotein fra en storstilet undersøgelse fra UW Medicine Institute for Protein Design. Kredit:UW Medicine Institute for Protein Design Scenen er sat til -
 Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert
Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert -
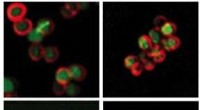 Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L
Forskere finder et potentielt potentielt våben til at overvinde antibiotikaresistensPseudomonas aeruginosa-producerede rhamnolipider målretter mod plasmamembranen af Staphylococcus aureus (mærket her med rødt) for at øge permeabiliteten for aminoglycosidantibiotika. Kredit:Conlon L -
 Processen til at tilpasse molekyler virker dobbeltRice University kandidatstuderende Kang-Jie (Harry) Bian opstiller lysfølsomme molekyler til et eksperiment i laboratoriet hos kemiker Julian West. Bian er hovedforfatter af en undersøgelse inspireret
Processen til at tilpasse molekyler virker dobbeltRice University kandidatstuderende Kang-Jie (Harry) Bian opstiller lysfølsomme molekyler til et eksperiment i laboratoriet hos kemiker Julian West. Bian er hovedforfatter af en undersøgelse inspireret
- Kemiske reaktioner involveret i bagning af en kage
- Test af Vlad the Impalers breve viser, at han kan have haft en tilstand, der forårsagede, at hans t…
- Er metalrust i kold varme eller vand?
- Ny metode til bedre interaktion mellem laser og materiale
- Hubble-astronomer samler vid udsigt over det udviklende univers
- Fremtidens piller:Forskere udvikler en måde, hvorpå de med succes kan give nanopartikelterapi oral…


