Hvad er elektronkonfigurationen til kobber?
[AR] 3D¹⁰ 4S¹
Her er grunden til, at dette er tilfældet:
* [ar] Repræsenterer elektronkonfigurationen af Argon, den ædle gas, der går forud for kobber på den periodiske tabel. Dette betyder, at kobber har den samme indre elektronkonfiguration som Argon.
* 3d¹⁰ Angiver, at 3D -underskalet er fuldstændigt fyldt med 10 elektroner.
* 4S¹ Angiver, at 4S -underskalet kun har en elektron.
hvorfor ikke [AR] 3d⁹ 4S²?
Du kan forvente, at kobber har denne konfiguration baseret på standardfyldningsordren. Imidlertid er en fuldstændig fyldt D -underskal mere stabil end en delvist fyldt. Den ekstra stabilitet, der er opnået ved at have en fuld 3D -underskal, opvejer den lette energifor ulempe ved kun at have et elektron i 4S -underskalet.
Sidste artikelHvad er forskellen mellem atomer af carbon -12 og -14?
Næste artikelEn elektron er til en beta -partikel som helium A?
 Varme artikler
Varme artikler
-
 Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v
Forsker kortlægger kæmpe virusKristin Parent kortlagde strukturen af den gigantiske Samba-virus med MSUs kryo-EM-mikroskop, som er omtalt på forsiden af bladet Virus . Kredit:Michigan State University I et laboratorium v -
 Påvisning af en ny reaktionsvej i atmosfærenPå TROPOS i Leipzig, holdet lykkedes med at demonstrere denne proces i laboratorieforsøg ved hjælp af et specielt flowapparat, der tillader interferensfrie eksperimenter med gasfasereaktioner ved atmo
Påvisning af en ny reaktionsvej i atmosfærenPå TROPOS i Leipzig, holdet lykkedes med at demonstrere denne proces i laboratorieforsøg ved hjælp af et specielt flowapparat, der tillader interferensfrie eksperimenter med gasfasereaktioner ved atmo -
 Spild ikke, vil ikke:en hjemmelavet plan om at gøre plast og dæk til brændstofKredit:Monash University Reducere, genbruge, genbruge. Som at børste tænder efter et måltid, genbrug er bare det rigtige at gøre. Men nu hvor Kina er holdt op med at tage vores skraldespand, vi k
Spild ikke, vil ikke:en hjemmelavet plan om at gøre plast og dæk til brændstofKredit:Monash University Reducere, genbruge, genbruge. Som at børste tænder efter et måltid, genbrug er bare det rigtige at gøre. Men nu hvor Kina er holdt op med at tage vores skraldespand, vi k -
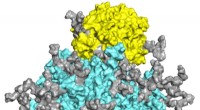 Ofte overset, molekyler kaldet glykaner regulerer COVID-19-spidsproteinfunktionenEn molekylær model viser det stærkt glykosylerede SARS-CoV-2-spidsprotein (cyan, med glykaner i grå og andre farver) bundet til den cellulære ACE2-receptor (gul). En ny undersøgelse fremhæver den krit
Ofte overset, molekyler kaldet glykaner regulerer COVID-19-spidsproteinfunktionenEn molekylær model viser det stærkt glykosylerede SARS-CoV-2-spidsprotein (cyan, med glykaner i grå og andre farver) bundet til den cellulære ACE2-receptor (gul). En ny undersøgelse fremhæver den krit
- Bor på kanten af en aktiv vulkan:Risiko fra lavastrømme på Etna
- Er mysteriet med Antarktis iskappe blevet løst?
- Kunne mere af Jordens overflade være vært for liv? Jupiters kredsløbsform spiller en vigtig, over…
- Hvilket element har det samme antal elektron orbitaler som natrium?
- Amazon ser øjnene på forsvar mod kapring af leveringsdroner af uhyggelige personer
- Klimaændringer afslører indviklet dynamik af reproduktive barrierer i marine arter


