6 Skriv en kemisk ligning, der viser reaktionen mellem ammoniak og bortrifluorid BF3 i Lewis-syre-base viser, hvordan kovalente bindinger dannes?
reaktion af ammoniak og bortrifluorid
Reaktionen mellem ammoniak (NH₃) og bortrifluorid (BF₃) er et klassisk eksempel på en Lewis-syre-base-reaktion.
Kemisk ligning:
NH₃ + BF₃ → H₃N:BF₃
Forklaring:
* lewis syre: BF₃ fungerer som en Lewis -syre, fordi den har en ufuldstændig oktet i bor og kan acceptere et elektronpar. Det har en ledig p-orbital på bor.
* Lewis Base: NH₃ fungerer som en Lewis -base, fordi den har et ensomt par elektroner på nitrogenatomet. Det kan donere et elektronpar.
Dannelse af kovalent binding:
1. Donation: Det ensomme par elektroner på nitrogenatomet i ammoniak doneres til den ledige p-orbitale på bor i bortrifluorid.
2. deling: Det delte elektronpar danner A koordinat kovalent binding (også kaldet en dativbinding) mellem nitrogen- og boratomer.
Repræsentation af den kovalente obligationsdannelse:
Følgende diagram illustrerer dannelsen af den koordinat kovalente binding:
`` `
H
|
H - N - H + F - B - F
| | |
H f f
↓
H
|
H - N - H → F - B - F
| | |
H f f
|
N → b
`` `
Konklusion:
Reaktionen mellem ammoniak og bortrifluorid resulterer i dannelsen af en koordinat kovalent binding mellem nitrogenatomet i ammoniak og boratomet af bortrifluorid. Dette er en Lewis-syre-base-reaktion, hvor ammoniak fungerer som en Lewis-base, der donerer et elektronpar, og bortrifluorid fungerer som en Lewis-syre, der accepterer elektronparret.
Sidste artikelEr ilt et element eller en forbindelse?
Næste artikelHvad er den sammensatte bor og fluor?
 Varme artikler
Varme artikler
-
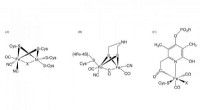 CO-biosyntese påkrævet til samling af det aktive sted i NiFe-hydrogenaseFigur 1. Struktur af de aktive steder i [NiFe] -hydrogenase, [FeFe] -hydrogenase, og [Fe] -hydrogenase Kredit:NINS/IMS En forskergruppe, der omfatter forskere fra Exploratory Research Center on Li
CO-biosyntese påkrævet til samling af det aktive sted i NiFe-hydrogenaseFigur 1. Struktur af de aktive steder i [NiFe] -hydrogenase, [FeFe] -hydrogenase, og [Fe] -hydrogenase Kredit:NINS/IMS En forskergruppe, der omfatter forskere fra Exploratory Research Center on Li -
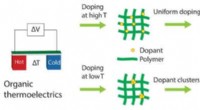 Sådan opfanges spildvarmeenergi med forbedrede polymererEt UMass Amherst-team af kemikere og elektriske ingeniører skitserer en ny måde at fremme en mere effektiv, billigere, polymer-baseret høst af varmeenergi til at producere elektricitet i et nyligt pap
Sådan opfanges spildvarmeenergi med forbedrede polymererEt UMass Amherst-team af kemikere og elektriske ingeniører skitserer en ny måde at fremme en mere effektiv, billigere, polymer-baseret høst af varmeenergi til at producere elektricitet i et nyligt pap -
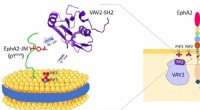 Forskere afslører dobbelt specificitet af Vav2-SH2-proteinVav2-protein binder til cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen. Kredit:HFIPS For nylig, et forskerhold ledet af prof. Wang Junfeng fra High Magnetic Field Lab
Forskere afslører dobbelt specificitet af Vav2-SH2-proteinVav2-protein binder til cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen. Kredit:HFIPS For nylig, et forskerhold ledet af prof. Wang Junfeng fra High Magnetic Field Lab -
 Forskere udvikler genbrug til kulfiberkompositterWashington State University professor Jinwen Zhang med sit forskergruppe for genbrug af kulfiber. Kredit:Washington State University Et WSU -forskerhold har for første gang udviklet en lovende måd
Forskere udvikler genbrug til kulfiberkompositterWashington State University professor Jinwen Zhang med sit forskergruppe for genbrug af kulfiber. Kredit:Washington State University Et WSU -forskerhold har for første gang udviklet en lovende måd
- Hvad er forholdet mellem struktur af et atom- og atomspektre?
- Teamet bruger diskret differentialgeometri til at karakterisere grafens form
- Jeg kan godt lide plastik:Pakistans giftige kærlighedsaffære med affald
- Sådan testes for blødt vand
- USA kæmper for at følge med, mens hampeindustrien vokser
- Hvilken funktion dominerer den phyiscal geografi i Mexico?


