Hvad er vigtigt, når man skriver den kemiske formel til uorganisk salt?
1. Identificer kationerne og anionerne
* kationer: Positivt ladede ioner (metaller eller ammonium, NH₄⁺).
* anioner: Negativt ladede ioner (ikke -metaller, polyatomiske ioner).
* Eksempel: I NaCl (natriumchlorid) er Na⁺ kationen, og cl⁻ er anionen.
2. Bestem gebyrerne
* Metaller: Brug den periodiske tabel til at bestemme den almindelige ladning. For eksempel har gruppe 1 -metaller (Li, Na, K) en +1 ladning, og gruppe 2 -metaller (BE, Mg, CA) har en +2 ladning.
* ikke -metaller: Disse har normalt en fast negativ ladning baseret på deres position på den periodiske tabel (halogener som CL, BR, jeg har en -1 -ladning).
* polyatomiske ioner: Husk de almindelige polyatomiske ioner og deres ladninger (f.eks. Sulfat SO₄²⁻, phosphat PO₄³⁻, nitrat NO₃⁻).
3. Afbalancering af gebyrerne
* Den samlede positive ladning skal svare til den samlede negative ladning.
* enkle salte:
* Hvis ladningerne er ens og modsatte, skal du skrive symbolerne side om side. For eksempel kombineres Na⁺ og Cl⁻ for at danne NaCl.
* Hvis gebyrerne ikke er ens, skal du bruge underskrifter til at indikere antallet af hver ion, der er nødvendigt for at afbalancere gebyrerne. For eksempel kombineres Ca²⁺ og Cl⁻ for at danne CACL₂ (en calciumion afbalancerer to chloridioner).
* komplekse salte:
* Brug parenteser til at omslutte polyatomiske ioner, hvis de vises mere end én gang. For eksempel (NH₄) ₂SO₄ (ammoniumsulfat).
* Nogle gange er det nødvendigt med et romersk tal i navnet for at indikere ladningen af metalkationen (f.eks. Jern (II) chlorid, fecl₂).
4. Skrivning af formlen
* Placer kationsymbolet først, efterfulgt af anionsymbolet.
* Brug underskrifter til at indikere antallet af hver ion, der er nødvendig til opladningsbalance.
* Eksempel:
* Magnesiumbromid:mg²⁺ og br⁻ -> mgbr₂
* Kaliumphosphat:k⁺ og po₄³⁻ -> k₃po₄
5. Forenkling af formlen
* Brug altid det enkleste forhold mellem hele nummeret på ioner.
vigtige noter
* navngivning: Lær reglerne for navngivning af uorganiske salte. For eksempel bruger de fleste binære salte (to elementer) navnet på metallet efterfulgt af ikke-metal med "-ide" i slutningen.
* Periodisk tabel: Brug den periodiske tabel som din primære ressource til at bestemme ladninger og almindelige oxidationstilstande for elementer.
* Praksis: Jo mere du praktiserer at skrive formler, jo mere behageligt bliver du med processen.
Fortæl mig, hvis du gerne vil have eksempler eller have specifikke salte, du vil prøve at skrive formler til!
Sidste artikelAntallet af molekyler hydrogenperoxid fundet i 3,15 mol H2O2 er?
Næste artikelDen kemiske formel for jernsulfat?
 Varme artikler
Varme artikler
-
 Molekylær spredning forbedrer kvasi-dobbeltlags organiske solcellerKredit:CC0 Public Domain I de sidste par år, organiske solceller (OSCer) baseret på ikke-fulleren (NF) acceptorer har vist enorme fremskridt med hensyn til effektkonverteringseffektivitet (PCE). S
Molekylær spredning forbedrer kvasi-dobbeltlags organiske solcellerKredit:CC0 Public Domain I de sidste par år, organiske solceller (OSCer) baseret på ikke-fulleren (NF) acceptorer har vist enorme fremskridt med hensyn til effektkonverteringseffektivitet (PCE). S -
 Et hjertesundt protein fra klid af kornafgrøderKredit:CC0 Public Domain Rævehale hirse er et etårigt græs, der dyrkes bredt som en kornafgrøde i dele af Indien, Kina og Sydøstasien. Maling af kornet fjerner det hårde ydre lag, eller klid, fra
Et hjertesundt protein fra klid af kornafgrøderKredit:CC0 Public Domain Rævehale hirse er et etårigt græs, der dyrkes bredt som en kornafgrøde i dele af Indien, Kina og Sydøstasien. Maling af kornet fjerner det hårde ydre lag, eller klid, fra -
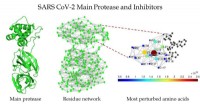 Målretning af SARS-CoV-2-enzym med inhibitorerSkematisk af hovedproteasen af SARS CoV-2 (venstre), proteinrestnetværket af hovedproteasen i SARS CoV-2 (i midten), og en zoomet visning af området omkring bindingsstedet som detekteret af Estrada
Målretning af SARS-CoV-2-enzym med inhibitorerSkematisk af hovedproteasen af SARS CoV-2 (venstre), proteinrestnetværket af hovedproteasen i SARS CoV-2 (i midten), og en zoomet visning af området omkring bindingsstedet som detekteret af Estrada -
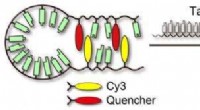 Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru
Cyaninfarvestoffer kunne forbedre effektiviteten af molekylære proberRNA-detektionsskema:Det hårnåleformede molekyle åbner sig hurtigt, kombineres med dets komplementære mål og fluorescerer klart. Kredit:Videnskab og teknologi for avancerede materialer Forskere bru
- Kæmpe galaktisk eksplosion afslører galakseforurening i aktion
- Hvad er det primære mineral, der findes i knoglematrix?
- Forbinder søer med øje på fremtiden
- Et ikke -vanedannende opioid smertestillende middel uden bivirkninger
- Apollo 15 astronaut Al Worden, der kredsede om månen, dør som 88-årig
- Hvad er domæneenzym?


