Hvordan danner salt og vand en opløsning?
1. Polaritet betyder noget:
* vand (H₂O) er et polært molekyle: Dette betyder, at det har en lidt positiv ende (nær hydrogenatomerne) og en lidt negativ ende (nær iltatomet). Denne ujævne fordeling af ladning skaber en "dipol."
* salt (NaCl) er en ionisk forbindelse: Det dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na⁺) og negativt ladede chloridioner (CL⁻).
2. Tiltrækning og dissociation:
* Vandmolekyler tiltrækker ioner i salt: Den positive ende af et vandmolekyle tiltrækkes af de negative chloridioner, mens den negative ende af vandmolekylet tiltrækkes af de positive natriumioner.
* Disse attraktioner trækker saltkrystaller fra hinanden: De stærke kræfter mellem vand og ionerne overvinder kræfterne, der holder natrium- og chloridioner sammen i krystalgitteret.
* salt dissocieres i ioner: De individuelle natrium- og chloridioner bliver omgivet af vandmolekyler og danner hydratiserede ioner.
3. Løsningsdannelse:
* hydrerede ioner bliver jævnt spredt: Vandmolekylerne isolerer effektivt ionerne fra hinanden og forhindrer dem i at rekombineres i saltkrystaller.
* Resultatet er en homogen blanding: Salt og vand danner en opløsning, hvor saltpartiklerne er helt opløst og jævnt fordelt over vandet.
Nøglepunkter:
* opløselighed: Et stof (som salt) til at opløses i et opløsningsmiddel (som vand) kaldes opløselighed. Salt er meget opløseligt i vand på grund af de stærke interaktioner mellem vandmolekyler og ionerne.
* Koncentration: Mængden af opløst salt i vandet bestemmer koncentrationen af opløsningen.
Fortæl mig, hvis du gerne vil udforske nogen af disse koncepter yderligere!
 Varme artikler
Varme artikler
-
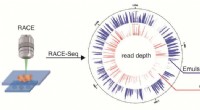 Forskere forbedrer metode, der forbinder genomet til at fungere for miljømæssige enkeltcellerProceduren for Raman-aktiveret celleudstødning og sekventering (RACE-Seq). Kredit:SU Xiaolu Celler er lidt nemmere at forstå, takket være forbedret teknologi udviklet af et team af forskere basere
Forskere forbedrer metode, der forbinder genomet til at fungere for miljømæssige enkeltcellerProceduren for Raman-aktiveret celleudstødning og sekventering (RACE-Seq). Kredit:SU Xiaolu Celler er lidt nemmere at forstå, takket være forbedret teknologi udviklet af et team af forskere basere -
 Nyt bærbart malariascreeningsinstrument udvikletLaserstrålen passerer gennem blodprøven og rammer detektoren på den anden side. To målinger foretages:en med magneten ved siden af prøven og en uden magneten. Hvis der er hæmozoin i blodet, det vil
Nyt bærbart malariascreeningsinstrument udvikletLaserstrålen passerer gennem blodprøven og rammer detektoren på den anden side. To målinger foretages:en med magneten ved siden af prøven og en uden magneten. Hvis der er hæmozoin i blodet, det vil -
 Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse
Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse -
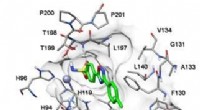 Kemikere har skabt forbindelser, der kan behandle glaukomDocking af en af de ramte forbindelser i human carbonic anhydrase II isoform. Kredit:Anton Shetnev Glaukom er en alvorlig sygdom forbundet med øget intraokulært tryk, ofte fører til blindhed. En
Kemikere har skabt forbindelser, der kan behandle glaukomDocking af en af de ramte forbindelser i human carbonic anhydrase II isoform. Kredit:Anton Shetnev Glaukom er en alvorlig sygdom forbundet med øget intraokulært tryk, ofte fører til blindhed. En
- Nye drejninger på tornadoer:Jordforsker undersøger, hvorfor USA har så mange tornadoer
- Hvilke tektoniske plader omgiver Japan?
- Binære stjerner med uforklarligt dæmpningsmønster
- Et værktøj til at give politiske beslutningstagere økonomiske data i realtid
- Ny langsomt udviklende Type Ibn supernova opdaget
- Når sollys skinner på ydersiden af månen. Dette kaldes?


