Når en ionisk forbindelse dannes mellem natrium- og bromatomer, hvad sker der?
1. Elektronoverførsel:
* natrium (NA) , et alkalimetal, har en valenselektron i sin yderste skal. Det mister let denne elektron for at opnå en stabil elektronkonfiguration som den ædle gas neon (NE).
* brom (Br) , en halogen, har syv valenselektroner. Det har brug for endnu en elektron for at opnå en stabil konfiguration som den ædle gas krypton (KR).
2. Dannelse af ioner:
* natrium (NA) Mister sin valenselektron og bliver en positivt ladet ion kaldet en natriumkation (Na+) .
* brom (Br) Få elektronet fra natrium og bliver en negativt ladet ion kaldet en bromid anion (br-) .
3. Elektrostatisk tiltrækning:
* De modsatte ladede ioner (Na+ og Br-) tiltrækkes nu af hinanden på grund af elektrostatiske kræfter. Denne attraktion er meget stærk og holder ionerne sammen i en stiv, krystallinsk struktur.
4. Dannelse af natriumbromid (NABR):
* Den resulterende forbindelse, natriumbromid (NABR) , er et hvidt krystallinsk fast stof. Det dannes gennem den stærke elektrostatiske attraktion mellem natriumkationer og bromidanioner.
Nøglepunkter:
* ionisk binding involverer overførsel af elektroner i modsætning til kovalent binding, der involverer elektrondeling.
* Dannelsen af ioner er vigtig for dannelsen af ioniske forbindelser.
* Den elektrostatiske tiltrækning mellem modsat ladede ioner er drivkraften bag dannelsen af ioniske forbindelser.
Sidste artikelHvorfor er kobbernitrat og svovl den samme farve?
Næste artikelGiver eller fjerner fluor elektroner under en kemisk binding?
 Varme artikler
Varme artikler
-
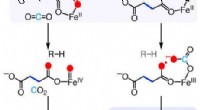 Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth
Vejen til fremstilling af ethylenMekanismer for de ethylen-dannende enzym (EFE) reaktioner. Ny forskning beskriver de kemiske trin, som dette naturligt forekommende enzym bruger til at omdanne en almindelig kemisk forbindelse til eth -
 Fremstilling af F-18 radiofarmaka til PET-billeddannelseKredit:CC0 Public Domain For nylig har ANSTO-forskere gjort fremskridt med at undersøge forbedrede måder at lave livreddende radiofarmaka på ved hjælp af fluor-18 radioisotopen, så de kan fås på f
Fremstilling af F-18 radiofarmaka til PET-billeddannelseKredit:CC0 Public Domain For nylig har ANSTO-forskere gjort fremskridt med at undersøge forbedrede måder at lave livreddende radiofarmaka på ved hjælp af fluor-18 radioisotopen, så de kan fås på f -
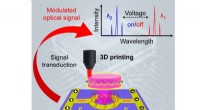 Ny rekord:3-D-printet optisk-elektronisk integrationSkematisk illustration af et integreret elektrisk styret mikrolasermodul til optoelektronisk hybridintegration. Kort, dette modul er designet til at være en termo-responsiv polymerresonator oven på et
Ny rekord:3-D-printet optisk-elektronisk integrationSkematisk illustration af et integreret elektrisk styret mikrolasermodul til optoelektronisk hybridintegration. Kort, dette modul er designet til at være en termo-responsiv polymerresonator oven på et -
 Video:Gallium og historien om det periodiske systemKredit:The American Chemical Society Nogle kemikere ser måske det periodiske system med elementer som et helligt vidnesbyrd om videnskabens magt. Imidlertid, da den først debuterede, det var en a
Video:Gallium og historien om det periodiske systemKredit:The American Chemical Society Nogle kemikere ser måske det periodiske system med elementer som et helligt vidnesbyrd om videnskabens magt. Imidlertid, da den først debuterede, det var en a
- Indbyggere i det nordvestlige Indiana, der er kede af raffinaderiforurening, tager klager til et off…
- Hvad er meningen med prøvestørrelse?
- Hvad er den enklest mulige enhed i en forbindelse?
- Er videnskab virkelig nyttig for menneskeheden?
- Sådan beregnes området af en rør
- Store muligheder for havforskning med nyt undervandsfartøj


