Er fluor lignende egenskaber som klor?
Ligheder:
* Elektronkonfiguration: Begge har 7 valenselektroner, hvilket gør dem meget reaktive og ivrige efter at få endnu en elektron for at opnå en stabil oktet.
* reaktivitet: Begge er meget reaktive ikke -metaller, der let danner ioniske bindinger med metaller og kovalente bindinger med andre ikke -metaller.
* Oxidationstilstand: Begge udviser ofte A -1 oxidationstilstand i forbindelser.
* danner diatomiske molekyler: Begge findes som diatomiske molekyler (F2 og CL2) i deres elementære form.
* Halogenegenskaber: De deler generelle halogenegenskaber som at være stærke oxidationsmidler og gode desinfektionsmidler.
Forskelle:
* Elektronegativitet: Fluor er det mest elektronegative element, hvilket betyder, at det har en stærkere attraktion for elektroner end klor.
* reaktivitet: Fluor er endnu mere reaktiv end klor og reagerer kraftigt med de fleste elementer, selv ved stuetemperatur.
* obligationsstyrke: Fluor danner stærkere bindinger end klor på grund af dets mindre atomstørrelse og højere elektronegativitet.
* Fysisk tilstand: Ved stuetemperatur er fluor en gas, mens chlor er en gas, men kan let fl være flydende.
* Farve: Fluor er en lysegul gas, mens klor er en grønlig gul gas.
Kortfattet:
Fluor og klor deler mange ligheder på grund af deres halogen -natur, men fluor er mere reaktiv og elektronegativ end klor, hvilket fører til nogle forskellige forskelle i deres kemiske egenskaber.
Sidste artikelHvor mange atomer er der i 1 g brintgas?
Næste artikelHvordan finder du de molære proportioner af hvert oxid?
 Varme artikler
Varme artikler
-
 Materiale med højt brydningsindeks bevarer høj transmissivitet efter udglødning ved 850 grader CPh.D. studerende Takuya Yoshimoto holder en film af amorft tantal yttriumoxid. Kredit:Toyohashi University of Technology Toyohashi University of Technology-forskere i samarbejde med Massachusetts
Materiale med højt brydningsindeks bevarer høj transmissivitet efter udglødning ved 850 grader CPh.D. studerende Takuya Yoshimoto holder en film af amorft tantal yttriumoxid. Kredit:Toyohashi University of Technology Toyohashi University of Technology-forskere i samarbejde med Massachusetts -
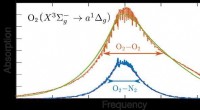 Forskere opdager, hvordan kolliderende iltmolekyler absorberer lysFigur:Eksperimentelle og teoretiske spektre for lysabsorption på grund af kollision af ilt (O2) molekyler med andre iltmolekyler og med nitrogen (N2) molekyler. Som vist her, absorptionen på grund af
Forskere opdager, hvordan kolliderende iltmolekyler absorberer lysFigur:Eksperimentelle og teoretiske spektre for lysabsorption på grund af kollision af ilt (O2) molekyler med andre iltmolekyler og med nitrogen (N2) molekyler. Som vist her, absorptionen på grund af -
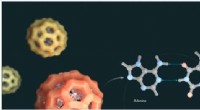 Levering af genetisk materiale med MOF'er til nye terapierI biomedicin kan metal-organiske rammer bruges til at levere lægemidler rundt i menneskekroppen. Et KAUST-ledet team har udviklet et MOF-baseret system til at få DNA over cellemembraner ind i målcelle
Levering af genetisk materiale med MOF'er til nye terapierI biomedicin kan metal-organiske rammer bruges til at levere lægemidler rundt i menneskekroppen. Et KAUST-ledet team har udviklet et MOF-baseret system til at få DNA over cellemembraner ind i målcelle -
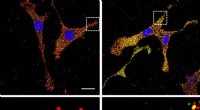 Billeddannelse af mRNA lige der, hvor det er lavet - på stedet for translationForskere bruger fluorescensprober til at overvåge stigninger i mRNA-ribosominteraktionsniveauer for et gen, der er forbundet med jernlagring som reaktion på jern (højre paneler). Målestok =20 μm. Kred
Billeddannelse af mRNA lige der, hvor det er lavet - på stedet for translationForskere bruger fluorescensprober til at overvåge stigninger i mRNA-ribosominteraktionsniveauer for et gen, der er forbundet med jernlagring som reaktion på jern (højre paneler). Målestok =20 μm. Kred
- Havde Einstein ret? Forskere giver det første offentlige kig på Gravity Probe B-resultaterne
- Portland planlægger at foreslå det første forbud mod ansigtsgenkendelse, der påvirker private vi…
- Den seneste fuldmåne var den 15. september ifølge Metonic Cycle, der vil igen være et 15 -års å…
- Hvad betyder Astrolabe?
- Havene varmes hurtigt op, undersøgelse siger
- Peyote er truet,


