Hvordan finder du de molære proportioner af hvert oxid?
Forståelse af molære proportioner
Molære proportioner fortæller os forholdet mellem mol af hvert element i en forbindelse. For oxider ser vi på forholdet mellem metal og ilt.
trin for at bestemme molære proportioner
1. Identificer elementerne: Bestem de elementer, der er til stede i oxidet.
2. Skriv den kemiske formel: Skriv den korrekte kemiske formel for oxidet.
3. Bestem underskrifterne: Bemærk underskrifterne (små tal), der følger hvert element i formlen. Disse underskrifter repræsenterer antallet af mol af hvert element i en mol af forbindelsen.
Eksempel 1:Jern (III) Oxid (Fe₂o₃)
1. elementer: Jern (Fe) og ilt (O)
2. Formel: Fe₂o₃
3. Subskripter: Subskriptet 2 efter Fe indikerer 2 mol jern. Underskriften 3 efter O angiver 3 mol ilt.
Derfor er de molære proportioner af jern (III) oxid 2:3 (Fe:O).
Eksempel 2:Aluminiumoxid (Al₂o₃)
1. elementer: Aluminium (AL) og ilt (O)
2. Formel: Al₂o₃
3. Subskripter: Underskriften 2 efter Al angiver 2 mol aluminium. Underskriften 3 efter O angiver 3 mol ilt.
Derfor er de molære proportioner af aluminiumoxid 2:3 (Al:O).
Vigtige noter:
* Empiriske formler: De kemiske formler, vi bruger i disse eksempler, er de empiriske formler, der repræsenterer det enkleste forhold mellem hele antal atomer i en forbindelse.
* forenkling af forhold: Nogle gange får du muligvis underskrifter, der kan forenkles. For eksempel, hvis du havde en formel som Fe₄o₆, ville du forenkle forholdet til 2:3 (Fe:O) ved at dele begge underskrifter med 2.
Lad mig vide, om du gerne vil øve med andre eksempler!
Sidste artikelEr fluor lignende egenskaber som klor?
Næste artikelEn blanding, der dannes, når et stof opløses et andet kaldes?
 Varme artikler
Varme artikler
-
 Alkymister af cellemiljøetKredit:CiQUS For at analysere, forstå, blande, og korrekt. At forske i livsmaskineri går gennem at dechifrere, hvordan celler, de mindre levende enheder i en organisme, arbejde. At være sund afhæn
Alkymister af cellemiljøetKredit:CiQUS For at analysere, forstå, blande, og korrekt. At forske i livsmaskineri går gennem at dechifrere, hvordan celler, de mindre levende enheder i en organisme, arbejde. At være sund afhæn -
 Røntgenlaserforskere udvikler en ny måde at se bakterier angribe antibiotikaEksperimentet blev udført på Coherent X-ray Imaging (CXI) instrument, der gør brug af den hurtige, strålende røntgenpulser fra Linac kohærente lyskilde. CXI anvender metoden diffraktion-før-ødelæggels
Røntgenlaserforskere udvikler en ny måde at se bakterier angribe antibiotikaEksperimentet blev udført på Coherent X-ray Imaging (CXI) instrument, der gør brug af den hurtige, strålende røntgenpulser fra Linac kohærente lyskilde. CXI anvender metoden diffraktion-før-ødelæggels -
 Nyt biomateriale kan erstatte plastlaminater, reducere forureningen kraftigtKredit:CC0 Public Domain Et billigt biomateriale, der kan bruges til bæredygtigt at erstatte plastbarrierebelægninger i emballage og mange andre applikationer, er blevet udviklet af Penn State-for
Nyt biomateriale kan erstatte plastlaminater, reducere forureningen kraftigtKredit:CC0 Public Domain Et billigt biomateriale, der kan bruges til bæredygtigt at erstatte plastbarrierebelægninger i emballage og mange andre applikationer, er blevet udviklet af Penn State-for -
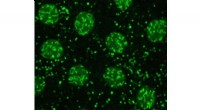 Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
- Koordinationskemi og Alzheimers sygdom
- Hvilke tre processer forekommer under dannelsen af sedimentære klipper?
- AI -projekt om maskinlæring vil have computere til at forudse, hvilke data brugere vil have
- Undersøgelse viser, at publikums domme kan identificere misinformation på nettet
- Kan megatesla magnetfelter realiseres på Jorden?
- Ny teknik kunne fremskynde produktionen af affald til metan


