Hvorfor oplever valenselektroner i nitrogen en større effektiv nuklearladning end beryllium?
1. Atomnummer: Nitrogen (N) har et atomnummer på 7, hvilket betyder, at det har 7 protoner i sin kerne. Beryllium (BE) har et atomnummer på 4 med 4 protoner. Det højere antal protoner i nitrogens kerne skaber en stærkere positiv ladning.
2. Elektronafskærmning: Elektroner i indre skaller beskytter valenselektroner mod kernenes fulde træk. Både nitrogen og beryllium har 2 elektroner i deres 1S -skal. Nitrogen har imidlertid 2 elektroner i sine 2S -skaller og 3 elektroner i sin 2p -skal, mens beryllium har 2 elektroner i sin 2S -skal.
3. Effektiv atomafgift (Zeff): Zeff er den nettopositive ladning, der opleves af en elektron. Jo mere afskærmende elektroner der er, jo lavere er Zeff.
* nitrogen: De 2 elektroner i 2'erne og 2p orbitaler af nitrogen er afskærmet af de 2 kerneelektroner (1s). De 5 protoner i kernen udøver en stærk attraktiv kraft på de 5 valenselektroner, hvilket resulterer i en højere Zeff.
* beryllium: De 2 valenselektroner i beryllium er afskærmet af de 2 kerneelektroner (1s). De 4 protoner i kernen udøver en svagere attraktiv kraft på de 2 valenselektroner, hvilket resulterer i en lavere zeff.
Kortfattet:
- Nitrogen har en større nuklear ladning på grund af flere protoner.
- Nitrogen har flere afskærmningselektroner i sine indre skaller sammenlignet med beryllium.
- Dette resulterer i en større effektiv nuklear ladning, som valenselektroner af nitrogen har oplevet, hvilket gør dem mere tæt bundet til kernen.
 Varme artikler
Varme artikler
-
 Atomaffald hører måske fortiden tilMatthew Fortunato samler kemikalier, der er nødvendige for forskning i at fjerne aktinider - de farligste, langlivede radioaktive grundstoffer – og kviksølv fra brugt radioaktivt brændstof. Kredit:Flo
Atomaffald hører måske fortiden tilMatthew Fortunato samler kemikalier, der er nødvendige for forskning i at fjerne aktinider - de farligste, langlivede radioaktive grundstoffer – og kviksølv fra brugt radioaktivt brændstof. Kredit:Flo -
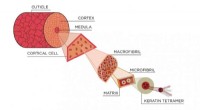 En løsning på et behåret problem inden for retsmedicinMenneskehår består af proteiner kaldet keratiner, der er viklet sammen til en holdbar struktur. Kredit:N. Hanacek/NIST I et forsøg på at gøre hårsammenligning til en mere nyttig teknik til at efte
En løsning på et behåret problem inden for retsmedicinMenneskehår består af proteiner kaldet keratiner, der er viklet sammen til en holdbar struktur. Kredit:N. Hanacek/NIST I et forsøg på at gøre hårsammenligning til en mere nyttig teknik til at efte -
 At finde nye biobaserede produkter fra lignin kan hjælpe med at skifte fra plastKredit:Bio4Products I det daglige liv er vi omgivet af fossile råvarer, fra produkter i vores biler, isolering i bygninger til køkkenudstyr, som pandehåndtag. Samfundet har brug for at finde nye m
At finde nye biobaserede produkter fra lignin kan hjælpe med at skifte fra plastKredit:Bio4Products I det daglige liv er vi omgivet af fossile råvarer, fra produkter i vores biler, isolering i bygninger til køkkenudstyr, som pandehåndtag. Samfundet har brug for at finde nye m -
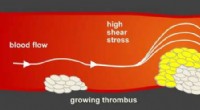 Antilock bremsesystem i arterier beskytter mod hjerteanfaldJo større blodprop, jo mindre plads har blodet til at flyde. Den øgede forskydningsspænding udløser en mekanisme, der naturligt hæmmer blodproppen. Kredit:Susanne Feil Tübingen biokemikere har opd
Antilock bremsesystem i arterier beskytter mod hjerteanfaldJo større blodprop, jo mindre plads har blodet til at flyde. Den øgede forskydningsspænding udløser en mekanisme, der naturligt hæmmer blodproppen. Kredit:Susanne Feil Tübingen biokemikere har opd
- Monsterbillede af Fornax Galaxy Cluster
- Magnetisering af en jern-vanadium-legering med laserimpulser kaster lys over et lovende fænomen
- Elektrisk 'Batmobile' afslører, hvordan kinesere har superbilmarkedet i kikkerten
- Radarundersøgelse rettet mod vindhændelser hos NASA, Air Force opsendelsesfaciliteter
- Hvad er kendetegnene ved ikke-levende ting?
- Sjov videnskabsprojekt ideer til 7. klasse


