Hvad sker der under enhver kemisk reaktion?
1. Omarrangement af atomer
* obligationer Break: De kemiske bindinger, der holder atomer sammen i reaktanterne, er brudt. Dette kræver energiindgang.
* obligationer form: Nye bindinger dannes mellem atomer, hvilket skaber produkterne. Denne proces frigiver energi.
2. Energiændringer
* eksotermiske reaktioner: Slip mere energi end de absorberer, hvilket resulterer i en nettofrigivelse af energi til omgivelserne. Produkterne har lavere energi end reaktanterne.
* endotermiske reaktioner: Absorber mere energi, end de frigiver, hvilket resulterer i en nettoabsorption af energi fra omgivelserne. Produkterne har højere energi end reaktanterne.
3. Bevarelse af masse
* loven om bevarelse af masse: Den samlede masse af reaktanterne inden reaktionen skal svare til den samlede masse af produkterne efter reaktionen. Atomer oprettes hverken eller ødelægges, men blot omarrangeres.
4. Ændringer i kemiske egenskaber
* Nye stoffer: Produkterne har forskellige kemiske egenskaber end reaktanterne. De er grundlæggende forskellige stoffer.
5. Aktiveringsenergi
* Energibarrieren: Kemiske reaktioner har brug for en vis mængde energi (aktiveringsenergi) for at komme i gang, selvom de er eksoterme. Denne energi hjælper med at bryde eksisterende bindinger og initierer reaktionen.
nøglepunkter at huske:
* Ikke alle reaktioner er synlige: Mange kemiske reaktioner forekommer på molekylært niveau og er ikke indlysende for vores sanser.
* reaktionshastigheder varierer: Reaktioner sker i forskellige hastigheder, påvirket af faktorer som temperatur, koncentration og tilstedeværelsen af katalysatorer.
* reversibilitet: Nogle reaktioner kan fortsætte i begge retninger, med reaktanter, der danner produkter og omvendt.
Lad mig vide, om du vil have et dybere dykk i et specifikt aspekt af kemiske reaktioner!
Sidste artikelEr samarium et metal eller metalloid?
Næste artikelNår natrium reagerer med vand, hvad gør det?
 Varme artikler
Varme artikler
-
 Manipulerede enzymer – forskere sætter milepæl i biokatalyseforskningKathrin Heckenbichler og Rolf Breinbauer og deres team formåede for første gang nogensinde at genoplære et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opg
Manipulerede enzymer – forskere sætter milepæl i biokatalyseforskningKathrin Heckenbichler og Rolf Breinbauer og deres team formåede for første gang nogensinde at genoplære et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opg -
 Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel
Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel -
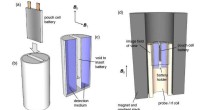 Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne
Kemikere udvikler MRI-lignende teknik til at opdage, hvad der fejler batterierEt team af kemikere har udviklet en MRI-baseret teknik, der hurtigt kan diagnosticere, hvad der fejler visse typer batterier - fra at bestemme, hvor meget ladning der er tilbage til at opdage interne -
 Find de faktorer, der påvirker stålkorrosionen mest i armeret beton mestMercedes Sánchez, undersøgelse af undersøgelsen. Kredit:Universidad de Córdoba Siden de egyptiske pyramider og det romerske Colosseum blev bygget, menneskeheden har ledt efter en overkommelig pris
Find de faktorer, der påvirker stålkorrosionen mest i armeret beton mestMercedes Sánchez, undersøgelse af undersøgelsen. Kredit:Universidad de Córdoba Siden de egyptiske pyramider og det romerske Colosseum blev bygget, menneskeheden har ledt efter en overkommelig pris
- Kunne du sammenligne og kontrastere enkel fra dampdestillation med hensyn til type blandinger adskil…
- Klimaændringer vil ændre den måde, vi lever på, men disse teknologiske og politiske eksperter se…
- Astronomer opdager den mest metalfattige ekstreme heliumstjerne
- Bevarelse af fortiden i 3D
- Hvordan mikroplast i jorden bidrager til miljøforurening
- Stoffer, der ikke vil opløses i Water


