Når en ion og atom er isoelektronisk?
Her er en sammenbrud:
* isoelektronisk: Udtrykket betyder bogstaveligt "lige elektroner".
* ion: Et atom, der har opnået eller mistet elektroner, hvilket resulterer i en nettopositiv eller negativ ladning.
* atom: En neutral enhed med et lige antal protoner og elektroner.
Eksempel:
* iltatom (O): Har 8 elektroner (8 protoner).
* fluoridion (F⁻): Har 10 elektroner (9 protoner). Det fik en elektron for at blive negativt ladet.
Både ilt og fluorion har 10 elektroner, hvilket gør dem isoelektroniske.
Nøglepunkter:
* isoelektroniske arter kan have forskellige antal protoner. Dette betyder, at de kan være forskellige elementer.
* Antallet af elektroner bestemmer den elektroniske konfiguration. Isoelektroniske arter har den samme elektroniske konfiguration.
* isoelektroniske arter har ofte lignende kemiske egenskaber. Dette skyldes deres lignende elektroniske konfigurationer.
Eksempler på isoelektroniske arter:
* na⁺, ne, f⁻ (alle har 10 elektroner)
* mg²⁺, Na⁺, Ne (alle har 10 elektroner)
* Ca²⁺, K⁺, AR (alle har 18 elektroner)
Fortæl mig, hvis du gerne vil have flere eksempler eller have yderligere spørgsmål!
 Varme artikler
Varme artikler
-
 Opladningsændring:Hvordan elektriske kræfter varierer i kolloiderKredit:CC0 Public Domain Ved beregning af elektrokinetisk kraft, konventionen har været at antage, at der ikke er nogen relativ hastighed af væsken i forhold til overfladen, hvilket gælder for hyd
Opladningsændring:Hvordan elektriske kræfter varierer i kolloiderKredit:CC0 Public Domain Ved beregning af elektrokinetisk kraft, konventionen har været at antage, at der ikke er nogen relativ hastighed af væsken i forhold til overfladen, hvilket gælder for hyd -
 Protein kamæleon farver langtidshukommelsenForskere ved Rice University modellerede bindingsstrukturerne af actin og associerede proteiner, som de mener er ansvarlige for dannelsen af langtidshukommelse. Her, beta-hårnåleformen af lynlåsse
Protein kamæleon farver langtidshukommelsenForskere ved Rice University modellerede bindingsstrukturerne af actin og associerede proteiner, som de mener er ansvarlige for dannelsen af langtidshukommelse. Her, beta-hårnåleformen af lynlåsse -
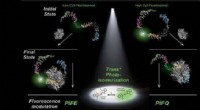 Ny eksperimentel indsigt giver forskere mulighed for at undersøge protein-DNA-interaktioner med stø…Den oprindelige tilstand af DNA-farvestofkomplekset bestemmer, om proteinbinding forøger eller slukker fluorescenssignalet. Kredit:KAUST En billedteknik med et enkelt molekyle, kaldet proteininduc
Ny eksperimentel indsigt giver forskere mulighed for at undersøge protein-DNA-interaktioner med stø…Den oprindelige tilstand af DNA-farvestofkomplekset bestemmer, om proteinbinding forøger eller slukker fluorescenssignalet. Kredit:KAUST En billedteknik med et enkelt molekyle, kaldet proteininduc -
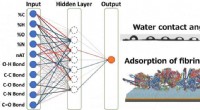 Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t
Et spring fremad for design af biomaterialer ved hjælp af AIKunstig neural netværksmodel, der bruges i dette arbejde Kredit: ACS Biomaterials Science &Engineering Forskere ved Tokyo Institute of Technology (Tokyo Tech) har brugt kunstig intelligens (AI) t
- Hvordan kan vandforurenende stoffer udvindes, så det er drikkeligt?
- Tysk politi razziaer Porsche-chefer i dieselsonde
- Renault lover ny start for alliance med Nissan
- Molekylær Lego til nanoelektronik
- En ny overvåget læringstilgang til at forstå planlægning i robotter
- Er kulnanorør den næste in-line til fremstilling af bærbar elektronik?


