Hvilket har et højere kogepunkt mellem NaCl og MgCl2?
Her er hvorfor:
* ionstyrke: Mg²⁺ har en højere ladningstæthed end Na⁺. Dette betyder, at tiltrækningen mellem Mg²⁺ -ioner og Cl⁻ioner er stærkere end tiltrækningen mellem na⁺ioner og cl⁻ioner.
* gitterenergi: Jo stærkere den ioniske attraktion er, jo højere er gitterenergien. MGCL₂ har en højere gitterenergi end NaCl.
* kogepunkt: En højere gitterenergi betyder, at der kræves mere energi for at bryde de ioniske bindinger og overføre forbindelsen til en gasformig tilstand. Derfor har MGCL₂ et højere kogepunkt end NaCl.
Kortfattet: Den højere ladningstæthed og stærkere ionisk attraktion i MGCL₂ resulterer i en højere gitterenergi og i sidste ende et højere kogepunkt.
Sidste artikelHvilket enzym konverterer hydrogenperoxid til vand og ilt?
Næste artikelHvad er opløseligheden af natriumacetattrihydrat?
 Varme artikler
Varme artikler
-
 Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet,
Mælkesyrebakterier kan forlænge fødevarers holdbarhedKredit:CC0 Public Domain Forskere ved National Food Institute, Tekniske Universitet Danmark, har genereret en mælkesyrebakterie, der effektivt udskiller et konserveringsmiddel af fødevarekvalitet, -
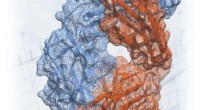 At lave strukturelle ændringer af antistof har potentiale til at reducere cancertumorerMolekylær struktur af Frizzled-signalmolekylet som genkendt af et antistof giver tegningerne til kræftterapeutisk finjustering. Kredit:Canadian Light Source Vejledt af blueprints produceret ved de
At lave strukturelle ændringer af antistof har potentiale til at reducere cancertumorerMolekylær struktur af Frizzled-signalmolekylet som genkendt af et antistof giver tegningerne til kræftterapeutisk finjustering. Kredit:Canadian Light Source Vejledt af blueprints produceret ved de -
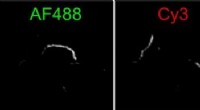 Hvordan bliver proteintangles så lange ved Alzheimers?Biofysikere har opdaget en ny mekanisme, hvormed aggregater af tauprotein, kaldet fibriller, kan vokse. To fibriller kan fastgøre ende-til-ende. Denne figur viser en fibril sammensat af mindre fibrill
Hvordan bliver proteintangles så lange ved Alzheimers?Biofysikere har opdaget en ny mekanisme, hvormed aggregater af tauprotein, kaldet fibriller, kan vokse. To fibriller kan fastgøre ende-til-ende. Denne figur viser en fibril sammensat af mindre fibrill -
 Omkostningseffektiv metode producerer halvledende film af materialer, der overgår siliciumMIT-forskere har udtænkt en måde at dyrke en enkelt krystal GaN tynd film på et GaN-substrat gennem todimensionelle materialer. Den tynde GaN-film eksfolieres derefter af et fleksibelt substrat, viser
Omkostningseffektiv metode producerer halvledende film af materialer, der overgår siliciumMIT-forskere har udtænkt en måde at dyrke en enkelt krystal GaN tynd film på et GaN-substrat gennem todimensionelle materialer. Den tynde GaN-film eksfolieres derefter af et fleksibelt substrat, viser


