Hvilken ende af vandmolekylet tiltrækkes af natriumion?
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (nær brintatomerne) og en lidt negativ ende (nær iltatomet).
* ionisk binding: Natriumioner (Na+) er positivt ladet.
* Elektrostatisk attraktion: De modsatte afgifter tiltrækker. Den lidt negative ilt ende af vandmolekylet tiltrækkes af den positive natriumion. Dette er et eksempel på en elektrostatisk interaktion .
Denne attraktion er det, der tillader natriumchlorid (NaCl) at opløses i vand. Vandmolekylerne omgiver natrium- og chloridioner, adskiller dem fra hinanden og holder dem i opløsning.
 Varme artikler
Varme artikler
-
 Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass
Trykpåvirkning er ikke skyld i tilsmudsning af membraner, undersøgelse finderEmily Tow PhD 17, viser udstyr, hun har udviklet til at måle virkningerne af forskellige trykniveauer på den måde, mikroorganismer opbygges på membraner, der bruges til afsaltning af vand. Kredit:Mass -
 Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk
Brændstof ud af den blå luft:Ny vej til opsamling og opgradering af CO2Geonhui Lee, Ph.d. -kandidat, driver en elektrolysator, der er i stand til at omdanne opløst carbonat til CO2 og derefter til syngas. Enheden tilbyder en ny, kortere vej til omdannelse af atmosfærisk -
 Brygning af øl, der smager frisk længereKredit:CC0 Public Domain I modsætning til vin, som generelt forbedres med tiden, øl ældes ikke godt. Normalt inden for et år efter aftapning, drikken begynder at udvikle en ubehagelig papiragtig e
Brygning af øl, der smager frisk længereKredit:CC0 Public Domain I modsætning til vin, som generelt forbedres med tiden, øl ældes ikke godt. Normalt inden for et år efter aftapning, drikken begynder at udvikle en ubehagelig papiragtig e -
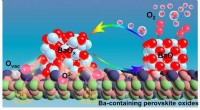 Mekanisme for oxygenaktivering på bariumholdige perovskitmaterialerOxygenaktiveringsmekanisme på Ba-holdige perovskitoxider. Kredit:Zhu Yue Et forskerhold ledet af prof. Yang Weishen og prof. Zhu Xuefeng fra Dalian Institute of Chemical Physics (DICP) fra det kine
Mekanisme for oxygenaktivering på bariumholdige perovskitmaterialerOxygenaktiveringsmekanisme på Ba-holdige perovskitoxider. Kredit:Zhu Yue Et forskerhold ledet af prof. Yang Weishen og prof. Zhu Xuefeng fra Dalian Institute of Chemical Physics (DICP) fra det kine
- Undersøgelse kaster lys over udviklingen af nye modgifte mod nervestoffer
- Sanctuary-politikker beskytter indvandrere, men truer ikke den offentlige sikkerhed
- Heads-up, CEO'er – virksomhedernes sociale ansvar kan få dig fyret, undersøgelse finder
- Hvor mange gram i 3 oz?
- Hvad er chancerne for liv på en anden planet?
- Undersøgelse viser, at regenererende orme har genetisk kontrol over deres algepartnere


