Hvorfor er klor mere reaktiv end svovl?
1. Elektronegativitet: Chlor har en højere elektronegativitet end svovl (3,16 mod 2,58). Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Den højere elektronegativitet af klor betyder, at den har et stærkere træk på delte elektroner, hvilket gør det mere sandsynligt, at det får elektroner og danner negative ioner.
2. Elektronaffinitet: Klor har en højere elektronaffinitet end svovl. Elektronaffinitet er ændringen i energi, når et elektron tilsættes et neutralt atom i den gasformige tilstand. Den højere elektronaffinitet af klor betyder, at den frigiver mere energi, når det får en elektron, hvilket gør det mere gunstigt for klor at få elektroner.
3. Ioniseringsenergi: Klor har en højere ioniseringsenergi end svovl. Ioniseringsenergi er den minimale energi, der kræves for at fjerne et elektron fra et gasformigt atom. Den højere ioniseringsenergi af klor gør det vanskeligere at fjerne et elektron, hvilket betyder, at det er mindre sandsynligt, at det mister elektroner og danner positive ioner.
4. Atomstørrelse: Klor er mindre end svovl. Den mindre størrelse af klor gør dens ydre elektroner mere tiltrukket af kernen, hvilket gør den mere reaktiv.
5. Antal valenselektroner: Klor har syv valenselektroner, mens svovl har seks. Klor behøver kun at vinde et elektron for at opnå en stabil oktet, hvilket gør det mere reaktivt med at vinde elektroner sammenlignet med svovl, der skal få to elektroner.
Kortfattet: Chlorens højere elektronegativitet, elektronaffinitet, ioniseringsenergi, mindre atomstørrelse og behov for kun en elektron for at opnå en stabil octet bidrager alle til dens højere reaktivitet sammenlignet med svovl.
 Varme artikler
Varme artikler
-
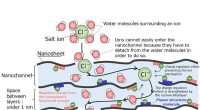 Meget funktionel membran udviklet til fremstilling af ferskvand fra havvandDiagram af membranen. Vandgennemtrængning induceres af nanokanalerne. Det er svært for ionerne at komme ind i nanokanalerne, så de kan ikke let trænge igennem membranen. Kredit:Kobe University Pro
Meget funktionel membran udviklet til fremstilling af ferskvand fra havvandDiagram af membranen. Vandgennemtrængning induceres af nanokanalerne. Det er svært for ionerne at komme ind i nanokanalerne, så de kan ikke let trænge igennem membranen. Kredit:Kobe University Pro -
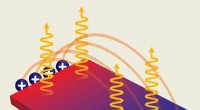 Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive
Exciplex-emission observeret over meget længere afstande end tidligere antaget muligtFigur 1:En langdistance-interaktion mellem elektroner (røde kugler) og huller (blå kugler) adskilt af en spacer giver anledning til exciplex-emission (orange kruseduller), der kunne bruges i effektive -
 Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti
Forskere henter bagergær i jagten på ny medicinGærceller mærket med farverige fluorescerende markører er vist. Kredit:Wikimedia Commons (Public Domain) En af de sværeste dele af opdagelse af lægemidler er at fastlægge, hvordan en medicin fakti -
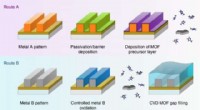 Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
Ny isoleringsteknik baner vejen for kraftigere og mindre spånerFig. 1 Fra:Dampaflejrede zeolitiske imidazolat-rammer som huludfyldende ultra-lav-k-dielektrikum To foreslåede ruter til integration af ultra-lav-k MOF-dielektrik i on-chip-forbindelser via MOF-CVD-pr
- Smarte byer:Løfter og fiaskoer i utopisk teknologisk planlægning
- Hvorfor chefer bør lade medarbejdere surfe på nettet på arbejdet
- Cirkulære byer i verden:Hvad kan grøn infrastruktur gøre?
- Nano-spejlsalen får molekyler til at blande sig med lys
- Hvordan sukkerelskende mikrober kan hjælpe med at drive fremtidige biler
- Astronomer opdager, hvordan hvide dværgstjerner får deres 'spark'


