Hvad er den samlede masse vand dannet, når 8 gram brint reagerer fuldstændigt med 64 ovygen?
1. Forstå den kemiske reaktion
Hydrogen (H₂) reagerer med ilt (O₂) for at danne vand (H₂O):
2H₂ + O₂ → 2H₂O
2. Beregn moller
* brint:
- Molær masse brint (H₂) =2 g/mol
- mol brint =8 g / 2 g / mol =4 mol
* ilt:
- Molmasse ilt (O₂) =32 g/mol
- mol ilt =64 g / 32 g / mol =2 mol
3. Bestem den begrænsende reaktant
Den begrænsende reaktant er den, der først forbruges fuldstændigt, hvilket begrænser mængden af dannet produkt.
* fra den afbalancerede ligning: 2 mol brint reagerer med 1 mol ilt.
* Vi har: 4 mol brint og 2 mol ilt.
* Dette betyder: Oxygen er den begrænsende reaktant, fordi det vil blive brugt op, før alt brint forbruges.
4. Beregn mol vand dannet
* fra den afbalancerede ligning: 1 mol ilt producerer 2 mol vand.
* Da vi har 2 mol ilt: Vi danner 2 mol ilt * 2 mol vand/mol ilt =4 mol vand.
5. Beregn masse vand
* Molær masse af vand (H₂O) =18 g/mol
* Masse vand =4 mol * 18 g/mol =72 g
Derfor er den samlede vandmasse dannet, når 8 gram brint reagerer fuldstændigt med 64 gram ilt er 72 gram
 Varme artikler
Varme artikler
-
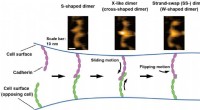 Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl
Visualisering af bindingsprocesser af celle-celle-adhæsionsmolekyler i opløsningHS-AFM billeder af cadherin dimererne er vist øverst. Bindingsmekanismen for cadheriner er illustreret i bunden baseret på HS-AFM-observationer. Kredit:Shigetaka Nishiguchi fra videnskabsmænd ved Expl -
 Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør
Fremstilling af lettere køretøjer med magnesiumlegeringerBarber kun 100 kg af en bils vægt, og du vil øge dens energieffektivitet med omkring 3,5 %. Kredit:iStock EPFL-forskere har udviklet modeller af magnesiumlegeringer for at forstå, hvordan man gør -
 Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens
Tarmbakterier er nøglen til fremstilling af universalblodKredit:Wikimedia Commons I januar, rasende storme forårsagede medicinske nødsituationer langs den amerikanske østkyst, får Røde Kors til at udsende en hasteopfordring til bloddonationer. Nationens -
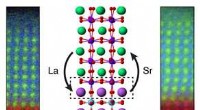 Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
Udnyttelse af tabte atomer kan hjælpe med at skabe nye, aldrig før sete oxiderKemisk kortlægning og illustration af atomare omlejring ved grænsefladen mellem to oxidmaterialer (La =lanthan; Sr =strontium). Kredit:PNNL At forstå, hvordan materialer dannes og kombineres med h
- Hvad er molekylet CCL4?
- Hvad sker der, når Pepsin blandes med mad i maven?
- Hvor mange måner gør
- Vil du dele gynækologiske data og høredata gennem en Apple-forskningsapp på iPhone?
- Kina sender lavtstående embedsmand til sikkerhedskonference
- At advare lokalsamfund om hyperlokaliserede byoversvømmelser


