Ville zink- og klorform ioniske bindinger?
* zink (Zn) er et metal og har en tendens til at miste to elektroner for at opnå en stabil elektronkonfiguration. Dette gør det til en kation med en +2 ladning (Zn²⁺).
* klor (Cl) er en ikke -metal og har en tendens til at få en elektron for at opnå en stabil elektronkonfiguration. Dette gør det til en anion med en -1 -afgift (Cl⁻).
Når zink- og chlorreaktioner, mister zinkatomer to elektroner hver, og to kloratomer får en elektron hver. Dette resulterer i dannelsen af den ioniske forbindelse zinkchlorid (ZnCl₂) :
* zn²⁺ + 2Cl⁻ → Zncl₂
Den elektrostatiske tiltrækning mellem de positivt ladede zinkioner og de negativt ladede chloridioner danner den ioniske binding.
Sidste artikelEr nitrogen en leder eller isolator af varme?
Næste artikelHvad er den sammensatte MGO et eksempel på?
 Varme artikler
Varme artikler
-
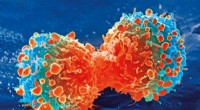 Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle
Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle -
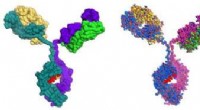 Ny biofarmaceutisk kvalitetskontrolmetode i testDet NIST monoklonale antistof (NISTmAb). Kredit:National Institute of Standards and Technology En ny metode til overvågning af biofarmaceutisk produktkvalitet blev for nylig sat på prøve af Nation
Ny biofarmaceutisk kvalitetskontrolmetode i testDet NIST monoklonale antistof (NISTmAb). Kredit:National Institute of Standards and Technology En ny metode til overvågning af biofarmaceutisk produktkvalitet blev for nylig sat på prøve af Nation -
 Ny metode til udvikling af cholinacetyltransferasehæmmereKredit:Wiley Enzymet cholinacetyltransferase (ChAT) katalyserer syntesen af neurotransmitteren acetylcholin og kunne være et målmolekyle for lægemidler. Et svensk forskerhold har nu fastslået de
Ny metode til udvikling af cholinacetyltransferasehæmmereKredit:Wiley Enzymet cholinacetyltransferase (ChAT) katalyserer syntesen af neurotransmitteren acetylcholin og kunne være et målmolekyle for lægemidler. Et svensk forskerhold har nu fastslået de -
 Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag
Fra gerningsstedet til retssalen - en DNA -prøves rejsePolitiet skal sikre, at prøver ikke er forurenet. Kredit:James Hereward og Caitlin Curtis, Forfatter angivet O.J. Simpson-mordssagen i 1995 introducerede DNA-kriminalteknik for offentligheden. Sag
- Navngiv to ting, der udfører mest nitrogenfiksering?
- iPhone XR gør de rigtige afvejninger til en billigere pris
- Forskning afslører grundlæggende fund om Jordens ydre kerne
- Gruppe bag Facebooks Libra coin push-møde i Genève
- Hvad er proteiner, der fremskynder visse kemiske reaktioner?
- Eksperter deler strategier for sikker genåbning af skoler


