Hvordan udfælder vandigt ammoniumsulfat proteiner?
1. Hydrofobe interaktioner:
* Proteiner er typisk opløselige i vand på grund af deres hydrofile (vandelskende) grupper, der danner brintbindinger med vandmolekyler.
* De indeholder imidlertid også hydrofobe (vandfrydende) grupper, der har tendens til at klynge sig sammen.
2. Ammoniumsulfats indflydelse:
* Når ammoniumsulfat tilsættes til en proteinopløsning, interagerer det med vandmolekylerne, hvilket effektivt fjerner dem væk fra proteinets hydrofile grupper.
* Denne forstyrrelse af hydratiseringsskaller omkring proteinet udsætter de hydrofobe grupper.
3. Aggregering og nedbør:
* Når koncentrationen af ammoniumsulfat øges, bliver de hydrofobe grupper på forskellige proteinmolekyler mere eksponeret og interagerer med hinanden, hvilket fører til aggregering.
* Til sidst bliver disse aggregater store nok til at blive uopløselige og udfælder ud af opløsningen.
Faktorer, der påvirker nedbør:
* Proteinkoncentration: Højere proteinkoncentrationer kræver højere ammoniumsulfatkoncentrationer til nedbør.
* Proteintype: Forskellige proteiner har forskellige grader af hydrofobicitet, hvilket fører til forskellige følsomheder over for ammoniumsulfatudfældning.
* ph: Opløsningens pH -værdi kan påvirke ladningen af proteinet og dets interaktion med ammoniumsulfat.
* Temperatur: Højere temperaturer forbedrer generelt proteinopløselighed, hvilket kræver højere ammoniumsulfatkoncentrationer til nedbør.
Anvendelser af ammoniumsulfatudfældning:
* Proteinoprensning: Det er en almindelig teknik til at koncentrere og delvis rense proteiner fra komplekse blandinger.
* Krystallisation: Ammoniumsulfat kan bruges til at fremme proteinkrystallisation, som er afgørende for strukturelle studier.
Fordele ved anvendelse af ammoniumsulfat:
* Relativt billig og let tilgængelig.
* Generelt ikke-denaturerende for proteiner, hvilket betyder, at det ikke ødelægger deres oprindelige struktur.
* Tillader selektiv nedbør baseret på proteinegenskaber.
Overvejelser:
* Det er vigtigt at optimere ammoniumsulfatkoncentrationen for hvert specifikt protein og det ønskede resultat.
* Bundfaldet kan indeholde andre molekyler udover målproteinet, hvilket kræver yderligere oprensningstrin.
* Nogle proteiner kan være følsomme over for høje saltkoncentrationer.
Afslutningsvis er ammoniumsulfatudfældning en værdifuld teknik til at adskille og rense proteiner ved at udnytte forskellene i deres hydrofobe interaktioner og opløselighed i nærvær af høje saltkoncentrationer.
 Varme artikler
Varme artikler
-
 Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola
Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola -
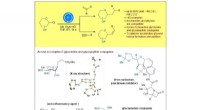 Titaniumkatalyse muliggør stereoselektiv syntese af C-glykosider og glycopeptiderFigur 1:Skematisk, der viser udviklingen af et generelt titaniumkatalyseret glycosylradikalfunktionaliseringsregime, der giver hurtig adgang til værdifulde C -alkyl og C -alkenylglycosider. Kred
Titaniumkatalyse muliggør stereoselektiv syntese af C-glykosider og glycopeptiderFigur 1:Skematisk, der viser udviklingen af et generelt titaniumkatalyseret glycosylradikalfunktionaliseringsregime, der giver hurtig adgang til værdifulde C -alkyl og C -alkenylglycosider. Kred -
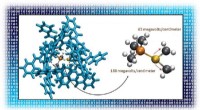 Optimering af elektriske felter giver bedre katalysatorerForstærkning af det elektriske felt i et molekyle kan gøre det til en bedre katalysator. Indpakning af en guldbaseret katalysator (venstre, center) i et større kompleks (blåt) forsyner katalysatoren m
Optimering af elektriske felter giver bedre katalysatorerForstærkning af det elektriske felt i et molekyle kan gøre det til en bedre katalysator. Indpakning af en guldbaseret katalysator (venstre, center) i et større kompleks (blåt) forsyner katalysatoren m -
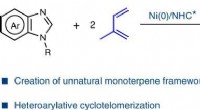 Forskere indser nikkel-katalyseret asymmetrisk heteroarylativ cyclotelomerisering af isoprenGrafisk abstrakt. Kredit:Nature Catalysis (2022). DOI:10.1038/s41929-022-00825-z Isopren bruges som en forløber til at producere terpener og terpenoider. Den direkte katalytiske omdannelse af isopr
Forskere indser nikkel-katalyseret asymmetrisk heteroarylativ cyclotelomerisering af isoprenGrafisk abstrakt. Kredit:Nature Catalysis (2022). DOI:10.1038/s41929-022-00825-z Isopren bruges som en forløber til at producere terpener og terpenoider. Den direkte katalytiske omdannelse af isopr
- Har joviske planeter en solid overflade?
- Hvilken slags pladegrænse findes, hvor Nordamerika og Caribiske plader mødes?
- Biobaseret forbindelse tilbyder et grønnere kulfiberalternativ
- Traditioner er vigtigere end vold, når oprørsstyrker regerer i Mellemøsten
- Hvad betyder det, når Venus og Jupiter stemmer overens på nattehimlen?
- Hvad sker ved fuldmåne, når Jorden passerer mellem og solen?


