Hvorfor kan ammoniumcarbonat bruges til at identificere både sure og alkaliske opløsninger?
* ammoniumcarbonat er et grundlæggende salt. Det hydrolyserer i vand og producerer ammoniumioner (NH₄⁺) og carbonationer (co₃²⁻). Karbonationerne reagerer med vand for at danne bicarbonationer (HCO₃⁻) og hydroxidioner (OH⁻), hvilket gør opløsningen grundlæggende.
* Grundlæggende løsninger Bliv rød lakmuspapir blå. Dette er en standardtest for alkalinitet. Ammoniumcarbonat, der er basisk, ville blive rødt lakmuspapir blåt.
* sure opløsninger Drej blåt lakmuspapir rød. Ammoniumcarbonat, der er basisk, ville ikke blive blåt lakmuspapirrød.
Kortfattet: Ammoniumcarbonat i sig selv er grundlæggende og kan derfor ikke bruges til at identificere sure opløsninger. Det er kun nyttigt til at identificere alkaliske opløsninger ved at dreje rød lakmuspapirblå.
Andre metoder til at identificere syrer og baser:
* pH -papir: Denne artikel ændrer farve afhængigt af pH i opløsningen og giver en mere præcis måling af surhed eller alkalinitet.
* indikatorer: Der findes mange andre kemiske indikatorer, hver med et specifikt farveændringsområde for forskellige pH -værdier.
* titrering: En kvantitativ metode til at bestemme koncentrationen af en ukendt syre eller base ved at reagere den med en opløsning af kendt koncentration.
 Varme artikler
Varme artikler
-
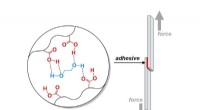 Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er
Hvordan laver man klæbemidler til elektronik, køretøjer, og konstruktion hårdere?Et Purdue University-team tilføjede bindinger, der let brydes i hele materialet for at styrke klæbemidlet. Kredit:Jonathan Wilker/Purdue University Gør dem hårdere ved at gøre dem svagere. Det er -
 Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her
Blæksprutte inspireret klæbemiddel fungerer under vandOctopus vulgaris. Billede:Wikipedia. (Phys.org) – Et team af forskere ved Sungkyunkwan University i Sydkorea har udviklet en type klæbeplaster, der fungerer under en række forskellige forhold, her -
 At bygge europæiske byer med træ ville binde og lagre halvdelen af cementindustriens nuværende …Aikalava-pavillonen blev bygget for at fejre Finlands 100-års fødselsdag. Kredit:Vesa Loikas Bygninger skaber en hel tredjedel af de globale drivhusgasemissioner - det er omkring 10 gange mere end
At bygge europæiske byer med træ ville binde og lagre halvdelen af cementindustriens nuværende …Aikalava-pavillonen blev bygget for at fejre Finlands 100-års fødselsdag. Kredit:Vesa Loikas Bygninger skaber en hel tredjedel af de globale drivhusgasemissioner - det er omkring 10 gange mere end -
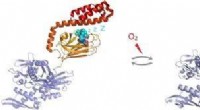 S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s
S-glutathionylering af human-inducerbar Hsp70 afslører reguleringsmekanisme, der involverer C-termi…Figur:Under oxidative stressforhold, den molekylære chaperon Hsp70 undergår post-translationel modifikation af cysteinrester ved tilsætning af tripeptidet glutathion. Glutathionylering inden for det s
- Hvorfor er 1 kg lig med 9,81 Newtons?
- Kvinder lige mænd i computerfærdigheder, men er mindre sikre
- Hvordan er en sø eller flod, der fryser over for organismerne i vand?
- Vil kernen i en stjerne med høj masse blive til Nutron Star?
- Hvad sker der, hvis du sætter et sort hul i solen?
- At hente en bog for sjov påvirker positivt verbale evner:studie


