Hvilke af følgende stoffer vil være opløselige i ikke -polær opløsningsmiddelcarbontetrachlorid CCL4 BR2 C6H14 NANO3 HCl forklare?
Forståelse af opløselighed
* "som opløser som" :Dette princip siger, at polære opløsningsmidler opløser polære opløste stoffer, og ikke -polære opløsningsmidler opløser ikke -polære opløste stoffer.
analyse af stofferne
* ccl4 (carbon tetrachlorid): Ikke -polært (symmetrisk molekyle uden noget signifikant dipolmoment)
* br2 (brom): Ikke -polært (diatomisk molekyle uden noget signifikant dipolmoment)
* C6H14 (hexan): Ikke-polær (carbonhydrid med kun C-H-bindinger)
* nano3 (natriumnitrat): Ionisk forbindelse, meget polær
* HCL (hydrogenchlorid): Polært kovalent molekyle (på grund af elektronegativitetsforskel mellem H og CL)
opløselighed i CCL4
Baseret på "som opløser som" princip:
* opløselig:
* ccl4: CCL4 opløses i sig selv (det er et ikke -polært opløsningsmiddel).
* br2: Brom er ikke -polær og vil opløses i CCL4.
* C6H14: Hexan er ikke -polær og vil opløses i CCL4.
* uopløselig:
* nano3: Natriumnitrat er ionisk og meget polær. Det opløses ikke i den ikke -polære CCL4.
* hcl: Hydrogenchlorid er polært og opløses ikke godt i den ikke -polære CCL4.
Derfor vil følgende stoffer være opløselige i carbontetrachlorid (CCL4):
* ccl4
* br2
* C6H14
Sidste artikelEn proces, hvor flydende vand bliver til damp?
Næste artikelHvordan gør brintbindinger isbjerge mulige?
 Varme artikler
Varme artikler
-
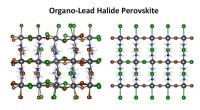 Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes -
 Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god -
 Ultrafølsom transistor til herbiciddetektion i vandForskere fra University of Tokyo har fremstillet en lille elektronisk sensor, der kan registrere meget lave niveauer af en almindeligt anvendt ukrudtsdræber i drikkevand. Kredit:Institut for Industriv
Ultrafølsom transistor til herbiciddetektion i vandForskere fra University of Tokyo har fremstillet en lille elektronisk sensor, der kan registrere meget lave niveauer af en almindeligt anvendt ukrudtsdræber i drikkevand. Kredit:Institut for Industriv -
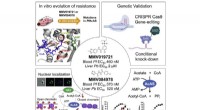 Biologiske ingeniører finder et nyt mål for malariamedicinGrafisk abstrakt. Kredit:DOI:10.1016/j.chembiol.2021.07.010 Hvert år, mere end 200 millioner mennesker er smittet med malaria, og næsten 500, 000 dør af sygdommen. Eksisterende lægemidler kan beha
Biologiske ingeniører finder et nyt mål for malariamedicinGrafisk abstrakt. Kredit:DOI:10.1016/j.chembiol.2021.07.010 Hvert år, mere end 200 millioner mennesker er smittet med malaria, og næsten 500, 000 dør af sygdommen. Eksisterende lægemidler kan beha
- Amerikanske mobiltelefondata afslører hotspots, hvor COVID-19-niveauet for social distancering er l…
- Lyver kvalitetssikring af nye stamceller:Makrofager foretager undersøgelsen
- Realtidsmåling af højhastighedsluftstrøm er 20 gange hurtigere end konventionelle metoder
- Hvad mener du, når du siger, at hver pulsar er en neutronstjerne, men ikke pulsar?
- Hvilken tidszone ligger mellem de østlige standard- og bjergtine -zoner?
- Tyrkisk cryptocurrency-boss anholdt i Albanien


