Hvordan kan antallet af valenselektroner, som kulstof har påvirke bindinger, carbond kan danne?
Sådan påvirker antallet af valenselektroner Carbon's binding:
* kovalent binding: Carbon's fire valenselektroner tillader det let at danne kovalente bindinger , deling af elektroner med andre atomer. Denne deling skaber stærke bindinger, der er essentielle for at opbygge komplekse molekyler.
* fire obligationer: Carbon danner typisk fire kovalente obligationer . Dette kan være igennem:
* enkelt obligationer: Deling af et elektron med et andet atom.
* dobbeltobligationer: Deling af to elektroner med et andet atom.
* Triple Bonds: Deling af tre elektroner med et andet atom.
* forskellige strukturer: Evnen til at danne enkelt-, dobbelt- og tredobbelt obligationer kombineret med sin evne til at binde med sig selv (catenation) giver kulstof mulighed for at danne en utrolig række strukturer. Dette inkluderer:
* lineære kæder: Fundet i alkaner som metan (CH4).
* forgrenede kæder: Fundet i forgrenede alkaner som isobutan (C4H10).
* ringe: Fundet i cykliske forbindelser som cyclohexan (C6H12).
* komplekse 3D -strukturer: Fundet i proteiner, kulhydrater og andre makromolekyler.
Sammenfattende gør Carbon's fire valenselektroner det til et alsidigt element, der er i stand til at danne en lang række kovalente bindinger, hvilket resulterer i den utrolige mangfoldighed og kompleksitet af organiske molekyler.
Sidste artikelHvad er egenskaber ved brint?
Næste artikelEr CO et kemisk symbol, men CO er formel?
 Varme artikler
Varme artikler
-
 Hvordan enzymer producerer brintMartin Winkler (højre) og Thomas Happe (venstre) har fanget et enzyms forbigående mellemliggende tilstand. Kredit:Ruhr-Universitaet-Bochum Forskere ved Ruhr-Universität Bochum og Freie Universität
Hvordan enzymer producerer brintMartin Winkler (højre) og Thomas Happe (venstre) har fanget et enzyms forbigående mellemliggende tilstand. Kredit:Ruhr-Universitaet-Bochum Forskere ved Ruhr-Universität Bochum og Freie Universität -
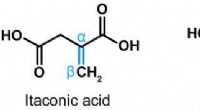 Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist.
Cellebeskyttelse, immunmodulering og virushæmning af et endogent stofStrukturer af isomererne af itaconsyre. Kredit:CC-BY F. Chen et al. Det endogene molekyle itaconsyre har antivirale og antiinflammatoriske virkninger, som forskere fra TWINCORE for nylig har vist. -
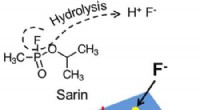 Forskere udvikler en hurtig og præcis metode til at opdage kemiske krigsførende midlerKemisk sort hul-baseret kemisk krigsførelsesmiddeldetektor. Kredit:University of Illinois Materials Research Laboratory Forskere ved University of Illinois i Urbana-Champaign har udviklet en senso
Forskere udvikler en hurtig og præcis metode til at opdage kemiske krigsførende midlerKemisk sort hul-baseret kemisk krigsførelsesmiddeldetektor. Kredit:University of Illinois Materials Research Laboratory Forskere ved University of Illinois i Urbana-Champaign har udviklet en senso -
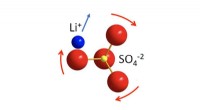 JCESR lægger grundlaget for mere sikker, batterier, der holder længerePaddlewheel -effekten. Over en bestemt temperatur, SÅ ?? ² anioner begynder at rotere, og samtidig i nærheden af Li? kationer bliver meget mobile. Linda Nazars arbejde viser, at i visse faste elektr
JCESR lægger grundlaget for mere sikker, batterier, der holder længerePaddlewheel -effekten. Over en bestemt temperatur, SÅ ?? ² anioner begynder at rotere, og samtidig i nærheden af Li? kationer bliver meget mobile. Linda Nazars arbejde viser, at i visse faste elektr
- Liste over ferromagnetiske metaller
- Vil du spise sundt og redde planeten? Erstat oksekød med Spirulina-alger, siger forskere
- Hvad er den nyttige mikroorganisme, der er til stede i ostemasse?
- Hvorfor har Mars sæsoner dobbelt så lange sæsoner?
- I en plante blev de reproduktive organer blive fundet?
- I Shawnee National Forest svirrer en debat omkring, hvordan man bedst beskytter træer midt i klimaæ…


