Hvad er molekylstruktur af ammoniak?
* form: Det centrale nitrogenatom er bundet til tre hydrogenatomer, der danner en pyramide med nitrogenet ved spidsen.
* binding: Nitrogenatomet har fem valenselektroner, hvoraf tre bruges til at danne enkelt kovalente bindinger med de tre hydrogenatomer. De resterende to elektroner danner et ensomt par.
* Hybridisering: Nitrogenatomet gennemgår SP³ -hybridisering, hvilket resulterer i fire SP³ -hybrid -orbitaler. Tre af disse orbitaler danner sigma -bindinger med hydrogenatomerne, mens den fjerde orbital indeholder det ensomme par.
* obligationsvinkler: H-N-H-bindingsvinklerne er ca. 107 °, lidt mindre end den ideelle tetrahedrale vinkel på 109,5 ° på grund af frastødningen mellem det ensomme par og bindingsparene af elektroner.
her er en visuel repræsentation:
[Billede af ammoniakmolekyle] (https://upload.wikimedia.org/wikipedia/commons/thumb/7/7a/ammonia-3d-balls.png/220px-ammonia-3d-balls.png)
Nøglefunktioner:
* polær: Ammoniak er et polært molekyle på grund af den ujævne fordeling af elektrondensitet forårsaget af det ensomme par på nitrogenatomet.
* Hydrogenbinding: Det ensomme par på nitrogenatomet tillader ammoniak at danne hydrogenbindinger med andre ammoniakmolekyler eller med vandmolekyler.
* Grundlæggende: Ammoniak er en svag base, fordi det ensomme par på nitrogenatomet kan acceptere en proton.
Fortæl mig, hvis du gerne vil have flere oplysninger om ammoniak!
Sidste artikelHvor mange atomer i 4 Na2CO3?
Næste artikelEr ilt et opløsningsmiddel eller opløsning?
 Varme artikler
Varme artikler
-
 Positionspecifikke isotopeffekter i butan-et nyt geokemisk sporstofKredit:Pixabay/CC0 Public Domain Positionsspecifik isotopanalyse (PSIA) er en teknik, der måler isotopsammensætningen af en bestemt position i et molekyle. Det kan give værdifuld information om
Positionspecifikke isotopeffekter i butan-et nyt geokemisk sporstofKredit:Pixabay/CC0 Public Domain Positionsspecifik isotopanalyse (PSIA) er en teknik, der måler isotopsammensætningen af en bestemt position i et molekyle. Det kan give værdifuld information om -
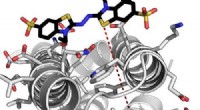 Kunstige enzymfunktioner samt naturlig versionBeregningsmodel for et yderst effektivt de novo -enzym, der interagerer med et af dets substrater. Den røde stiplede linje angiver elektrontunnelafstanden mellem det proteinbundne hæmmolekyle og det b
Kunstige enzymfunktioner samt naturlig versionBeregningsmodel for et yderst effektivt de novo -enzym, der interagerer med et af dets substrater. Den røde stiplede linje angiver elektrontunnelafstanden mellem det proteinbundne hæmmolekyle og det b -
 Forskere udvikler bionedbrydeligt trykt displayTakket være dens fleksibilitet og vedhæftning, det bionedbrydelige display kan bæres direkte på hånden. Kredit:Manuel Pietsch, KIT I de næste år, stigende brug af elektroniske enheder i forbrugsva
Forskere udvikler bionedbrydeligt trykt displayTakket være dens fleksibilitet og vedhæftning, det bionedbrydelige display kan bæres direkte på hånden. Kredit:Manuel Pietsch, KIT I de næste år, stigende brug af elektroniske enheder i forbrugsva -
 Biomedicinske ingeniører skaber smarte bandager til at hele kroniske sårEn UConn -forsker har hjulpet med at udvikle en ny smart bandage, der kan forbedre den kliniske pleje. Kredit:Dr. Ali Tamayol Kroniske og ikke-helende sår - en af de mest ødelæggende komplikatio
Biomedicinske ingeniører skaber smarte bandager til at hele kroniske sårEn UConn -forsker har hjulpet med at udvikle en ny smart bandage, der kan forbedre den kliniske pleje. Kredit:Dr. Ali Tamayol Kroniske og ikke-helende sår - en af de mest ødelæggende komplikatio
- Sådan beregnes Skew
- Gravitationskraften mellem to kroppe er F, når de er 1 meter fra hinanden, hvad vil der være den, …
- Som elektromagnetisk energi fra en varmekilde interagerer med sit miljø, er den?
- Forskere løser mysteriet om, hvordan gasbobler dannes i væske
- Curiosity rover klatrer gennem dramatisk stribet terræn på Mars
- Indirekte udvikling kontra direkte udvikling


