Hvad er reaktionen af kaliumchromat med bariumsulfat?
* opløselighedsregler: Bariumsulfat (baso₄) er meget uopløselig i vand. Kaliumchromat (k₂cro₄) er opløseligt i vand.
* Dobbeltfortrængning: En dobbeltfortrængningsreaktion kunne forekomme, hvis reaktanterne var opløselige. Imidlertid er dannelsen af et bundfald, som er en drivkraft for sådanne reaktioner, ikke mulig her.
* Intet gunstigt produkt: Der er ingen stærk drivkraft for, at reaktionen fortsætter. Produkterne fra en potentiel dobbeltfortrængning ville være bariumchromat (Bacro₄) og kaliumsulfat (K₂so₄), som begge er uopløselige. Bariumchromat er imidlertid endnu mindre opløseligt end bariumsulfat, så det ville ikke dannes i betydelige mængder.
I det væsentlige forbliver begge reaktanter i opløsning, og der opstår ingen synlig ændring.
Sidste artikelÆndrer kondenser en flydende det til gas?
Næste artikelHvad sker der, når benzen reagerer med CH3COCL i nærvær OA ALCL3?
 Varme artikler
Varme artikler
-
 Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H
Forskere udvikler en ny raman-spektroskopiplatform til at karakterisere IDP'er i fortyndet opløsnin…En illustration, der viser det optiske pincet-kontrollerede hotspot til proteinstrukturkarakteriseringen ved overfladeforstærket Raman-spektroskopi. Kredit:Vince St. Dollente Mesias, Jinqing Huang / H -
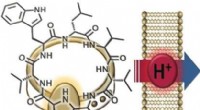 Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige
Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokationKredit:Wiley Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige -
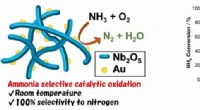 Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit
Gennembrud inden for luftrensning med en katalysator, der virker ved stuetemperatur(venstre) Forenklet skematisk oversigt over guldnanopartikler fastgjort til en ramme af nioboxid. (højre) Konverteringseffektivitet af filter med og uden guld, plus selektivitet til omdannelse til nit -
 Video:Natto, den stinkende, slimet sojasnackKredit:The American Chemical Society Natto, en fødevare lavet af fermenterede sojabønner, slukker ofte nybegyndere til japansk mad på grund af dens stærke lugt og trævlede slim. Men mange mennesk
Video:Natto, den stinkende, slimet sojasnackKredit:The American Chemical Society Natto, en fødevare lavet af fermenterede sojabønner, slukker ofte nybegyndere til japansk mad på grund af dens stærke lugt og trævlede slim. Men mange mennesk
- I en plante blev de reproduktive organer blive fundet?
- Hvad er forskellen mellem naturressourcer og kapitalressourcer?
- Global undersøgelse af verdens strande viser trussel mod beskyttede områder
- Hvordan adskiller en binær forbindelse sig fra polyatomisk ion?
- Hvad er tre måder at accelerere på i en lige linje?
- Hvad er Glykagon?


