Hvad sker der med natriumchloridkrystaller, når de tilsættes 10 ml vand?
1. opløsning: Natriumchloridkrystaller opløses i vandet. Dette betyder, at de ioniske bindinger, der holder natrium (Na+) og chlorid (Cl-) ioner sammen i krystalgitteret, er brudt.
2. Hydrering: Vandmolekylerne omgiver de frigjorte Na+ og Cl- ioner. Den positive ende af vandmolekylet (brint) tiltrækkes af de negativt ladede kloder, og den negative ende af vandmolekylet (ilt) tiltrækkes af de positivt ladede Na+ -ioner. Denne proces kaldes hydrering.
3. Dannelse af en vandig opløsning: De hydratiserede Na+ og cl- ioner bliver ensartet spredt over hele vandet og danner en homogen blanding kaldet en vandig opløsning.
Hvad du observerer:
* Krystallerne forsvinder: Du vil bemærke, at saltkrystaller gradvist forsvinder, når de opløses.
* vandet bliver salt: Opløsningen vil smage salt på grund af de opløste natriumchloridioner.
Vigtig note: Mængden af natriumchlorid, der opløses i 10 ml vand, er begrænset af opløseligheden af natriumchlorid. Ved stuetemperatur kan vand opløses omkring 36 gram natriumchlorid pr. 100 ml. Hvis du tilføjer mere end dette beløb, opløses det overskydende salt ikke og vil slå sig ned i bunden af beholderen.
 Varme artikler
Varme artikler
-
 En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive
En tungvægtsløsning til lettere kampkøretøjerFriction Stir Dovetailing er en proces, der forbinder tykke plader af aluminium til stål. Den nye proces vil blive brugt til at lave lettere militærkøretøjer, der er mere adrætte og brændstofeffektive -
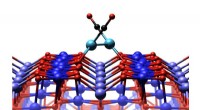 Udforsker monoatomiske platinkatalysatorerJernoxidoverfladen med to platinatomer, som hver er knyttet til et carbonmonoxidmolekyle. Kredit:TU Wien Hvad sker der, når en kat klatrer op på en solsikke? Solsikken er ustabil, vil hurtigt bøje
Udforsker monoatomiske platinkatalysatorerJernoxidoverfladen med to platinatomer, som hver er knyttet til et carbonmonoxidmolekyle. Kredit:TU Wien Hvad sker der, når en kat klatrer op på en solsikke? Solsikken er ustabil, vil hurtigt bøje -
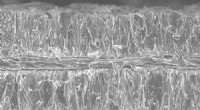 Galvanisering giver høj energi, højeffekts batterierEt elektronmikrografi-tværsnit viser aluminiumsfolie belagt med lithium-koboltoxid, et almindeligt materiale i lithium-ion-batterier. Kredit:Billede udlånt af Hailong Ning og Jerome Davis III, Xerion
Galvanisering giver høj energi, højeffekts batterierEt elektronmikrografi-tværsnit viser aluminiumsfolie belagt med lithium-koboltoxid, et almindeligt materiale i lithium-ion-batterier. Kredit:Billede udlånt af Hailong Ning og Jerome Davis III, Xerion -
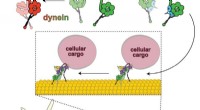 Biokemikere afslører molekylær mekanisme til motorisk proteinreguleringlissencephaly-1, eller Lis1 protein, aktiverer dynein-motoren, så den kan transportere cellulær last. Dyneinen skifter mellem off (venstre) og on (højre). Lis1 binder til dynein, når den er tændt, for
Biokemikere afslører molekylær mekanisme til motorisk proteinreguleringlissencephaly-1, eller Lis1 protein, aktiverer dynein-motoren, så den kan transportere cellulær last. Dyneinen skifter mellem off (venstre) og on (højre). Lis1 binder til dynein, når den er tændt, for
- Sorte amerikanere bærer hovedparten af coronakrisen. Dette burde ikke komme som nogen overraskels…
- Sådan håndteres vandsystemer for langsigtet bæredygtighed
- Underlig fysik:Jo tættere du kommer på solen,
- ISS bevæger sig for at undgå rumaffald
- Brug lysenergi i en sætning?
- Hvad er virkningen af kolde temperaturer på magneter?


