Hvor mange mol gas er i en kolbe ved 95 grader Celsius og 748 Torr, hvis det samlede volumen er 263 ml?
1. Konverter enheder:
* temperatur (t): 95 grader Celsius til Kelvin:95 + 273,15 =368,15 K
* tryk (p): 748 torr til atmosfærer:748 torr / 760 torr / atm =0,984 atm
* volumen (v): 263 ml til liter:263 ml / 1000 ml / l =0,263 L
2. Ideel gaslovligning:
Den ideelle gaslov er:PV =NRT
* P =pres (ATM)
* V =volumen (l)
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (k)
3. Løs for N (antal mol):
n =pv / rt
n =(0,984 atm * 0,263 L) / (0,0821 L · ATM / mol · K * 368,15 K)
n ≈ 0,0085 mol
Derfor er der ca. 0,0085 mol gas i kolben.
 Varme artikler
Varme artikler
-
 Højtliggende fugle udvikler lignende egenskaber via forskellige mutationerEn gengivelse af aviær hæmoglobin, blodproteinet, der fanger og leverer ilt i hele kroppen. Kredit:Proceedings of the National Academy of Sciences USA På det tibetanske plateau i Himalaya og Altip
Højtliggende fugle udvikler lignende egenskaber via forskellige mutationerEn gengivelse af aviær hæmoglobin, blodproteinet, der fanger og leverer ilt i hele kroppen. Kredit:Proceedings of the National Academy of Sciences USA På det tibetanske plateau i Himalaya og Altip -
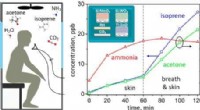 Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f
Bærbar enhed til at snuse ud fangede menneskerKredit:American Chemical Society Det første trin efter bygninger kollapsede fra et jordskælv, bombning eller anden katastrofe er at redde mennesker, der kunne blive fanget i murbrokkerne. Men at f -
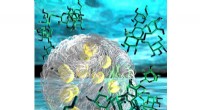 Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s
Syntetisk organel viser, hvordan bittesmå vandpytter-organer i vores celler fungererEn illustration af en del af en syntetisk organel uden membran. Her ser vi to lag, der fase adskilles som olie og vand, men begge lag er vand. Der er ingen olie. Hvert lag indeholder et andet opløst s -
 Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud
Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud
- Ny robot plukker et stykke peberfrugter og meget mere
- Hvad er Halifaxs længdegrad og breddegrad?
- Ny tilgang optimerer brugen af fremtidige bølgeelektriske generatorer under katastrofe
- Hvordan man fortæller glas fra Quartz
- Bykompostprogrammer gør skrald til sort guld, der øger fødevaresikkerheden og social retfærdighe…
- Cypern opfordrer til at udforske offshore-gas


