Hvor mange liter iltgas er til stede i 11,3 gram gas?
1. Konverter gram til mol:
* Den molære masse af iltgas (O₂) er 32 g/mol (16 g/mol for hvert iltatom).
* Opdel massen af iltgas med dens molære masse:11,3 g / 32 g / mol =0,353 mol
2. Brug den ideelle gaslov:
* Den ideelle gaslov er PV =NRT, hvor:
* P =tryk (vi antager standardtryk, 1 atm)
* V =lydstyrke (hvad vi vil finde)
* n =antal mol (0,353 mol)
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur (vi antager standardtemperatur, 273 K)
3. Løs for volumen (v):
* Omarranger den ideelle gaslov:V =NRT/P
* Tilslut værdierne:v =(0,353 mol) (0,0821 l · atm / mol · k) (273 K) / (1 atm)
* Beregn:V ≈ 8,01 L
Derfor er cirka 8,01 liter iltgas til stede i 11,3 gram iltgas ved standardtemperatur og tryk.
 Varme artikler
Varme artikler
-
 Højteknologisk sensing belyser betonstresstestEt billede fra et fotonisk kamera, der viser, hvordan brug af belægningen kan skabe en stearinlyslignende flamme, der fremhæver forskydningsspændingsfordelingen i en prøvebetonbjælke. Kredit:Universit
Højteknologisk sensing belyser betonstresstestEt billede fra et fotonisk kamera, der viser, hvordan brug af belægningen kan skabe en stearinlyslignende flamme, der fremhæver forskydningsspændingsfordelingen i en prøvebetonbjælke. Kredit:Universit -
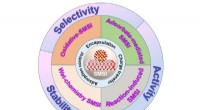 Nye ruter til konstruktion af stærke metal-støtte-interaktionerForskellige nye ruter til konstruktion af SMSIer blev afsluttet, hvor aktiviteten, selektiviteten og stabiliteten af de understøttede metalkatalysatorer modificeres, hvilket giver en effektiv måde a
Nye ruter til konstruktion af stærke metal-støtte-interaktionerForskellige nye ruter til konstruktion af SMSIer blev afsluttet, hvor aktiviteten, selektiviteten og stabiliteten af de understøttede metalkatalysatorer modificeres, hvilket giver en effektiv måde a -
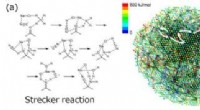 Slå tilbage for at forudsige kemiske reaktioner i flere trinGenererede strukturer og reaktionsvejetværk for de forudsagte reaktionstrin for Strecker-reaktionen (a) og Passerini-reaktionen (b). Hvide pile viser flertrinsvejen svarende til den kendte reaktionsme
Slå tilbage for at forudsige kemiske reaktioner i flere trinGenererede strukturer og reaktionsvejetværk for de forudsagte reaktionstrin for Strecker-reaktionen (a) og Passerini-reaktionen (b). Hvide pile viser flertrinsvejen svarende til den kendte reaktionsme -
 3-D gråskala digital lysudskrivning (g-DLP) materialer med høj funktionsgrad (FGM)Kompression af 3D anisotropt gitter. Kompression af det 3D isotrope gitter. Filmafspilningshastigheden er 10X fremspoling. Kompressionstestene blev udført i forskellige retninger. Kredit:Science Advan
3-D gråskala digital lysudskrivning (g-DLP) materialer med høj funktionsgrad (FGM)Kompression af 3D anisotropt gitter. Kompression af det 3D isotrope gitter. Filmafspilningshastigheden er 10X fremspoling. Kompressionstestene blev udført i forskellige retninger. Kredit:Science Advan
- Hvilket mekanisk lag sidder på asthenosfæren?
- Er stalaktitter og stalagmitter stødende eller sedimentære?
- Det bolivianske observatorium indsamler data, når gletsjere smelter
- Hvad kaldes det, når en objekter hastighed falder?
- Hvor mange milliliter 0,45 M HCl vil neutrilisere 25,0 ml 1,00 M KOH?
- Cassiopeias spøgelse


