16 L ammoniak blev produceret ved Haber -processen Hvor mange liter brint, der blev brugt under reaktion?
1. Afbalanceret kemisk ligning:
HaBer -procesreaktionen er:
N₂ (g) + 3H₂ (g) ⇌ 2nh₃ (g)
Dette fortæller os, at 3 mol brintgas (H₂) reagerer på produktion af 2 mol ammoniak (NH₃).
2. Molforhold:
Molforholdet mellem brint og ammoniak er 3:2. Dette betyder for hver 2 mol produceret ammoniak, 3 mol brint forbruges.
3. Forudsat at ideel gasadfærd:
Vi kan bruge den ideelle gaslov til at relatere mol og volumen. Da vi har at gøre med gasser ved konstant temperatur og tryk, kan vi antage, at volumenet er direkte proportional med antallet af mol.
4. Beregning:
* Da vi har 16 le ammoniak, er vi nødt til at finde ud af, hvor mange liter brint der er nødvendigt for at producere dette beløb.
* Ved hjælp af molforholdet ved vi, at der er behov for 3 mol brint for hver 2 mol ammoniak. Dette betyder et volumenforhold på 3:2.
* For at finde mængden af brint kan vi oprette en andel:
(3 l h₂) / (2 l nh₃) =(x l h₂) / (16 l nh₃)
* Løsning for X (volumen af brint):
x =(3 l h₂ * 16 l nh₃) / (2 l nh₃) =24 l h₂
Svar: 24 liter brintgas blev anvendt til at producere 16 liter ammoniak.
 Varme artikler
Varme artikler
-
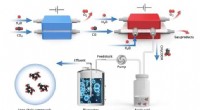 Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen
Hybrid elektro-biosystem opcykler kuldioxid til energirige langkædede forbindelserSkematisk diagram af in vitro kuldioxidsyntese af højenergi-langkædede fødevaremolekyler. Kredit:SIAT Kunstig upcycling af kuldioxid (CO2 ) til værditilvækstprodukter på en bæredygtig måde repræsen -
 Gør almindelig mad ekstraordinærSidsteårs FST-studerende Chew Ding Xiang holder en flaske højtryksforarbejdet bok choyjuice. Denne forbedrede version bevarer næringsstoffer godt, og bevarer grøntsagernes smag. Kredit:National Univer
Gør almindelig mad ekstraordinærSidsteårs FST-studerende Chew Ding Xiang holder en flaske højtryksforarbejdet bok choyjuice. Denne forbedrede version bevarer næringsstoffer godt, og bevarer grøntsagernes smag. Kredit:National Univer -
 Forøgelse af niveauer af gode fedtstoffer med et eksperimentelt lægemiddel, der virker på to nyli…Fra venstre:Justin Wang, Alan Saghatelian og Meric Erikci Ertunc. Kredit:Salk Instituttet Forskere fra Salk og Scripps Research Institute, sammen med samarbejdspartnere hos medicinalvirksomheden L
Forøgelse af niveauer af gode fedtstoffer med et eksperimentelt lægemiddel, der virker på to nyli…Fra venstre:Justin Wang, Alan Saghatelian og Meric Erikci Ertunc. Kredit:Salk Instituttet Forskere fra Salk og Scripps Research Institute, sammen med samarbejdspartnere hos medicinalvirksomheden L -
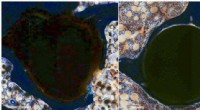 Ikke -toksisk, biologisk nedbrydeligt ortopædisk implantat kan give overlegen støtte til beskadige…Purdue -forskere udvikler et bionedbrydeligt ortopædisk metalimplantat, der sikkert kan absorberes af kroppen. Billedet til venstre er et histologisk (celle) billede af de Purdue-udviklede metalstifte
Ikke -toksisk, biologisk nedbrydeligt ortopædisk implantat kan give overlegen støtte til beskadige…Purdue -forskere udvikler et bionedbrydeligt ortopædisk metalimplantat, der sikkert kan absorberes af kroppen. Billedet til venstre er et histologisk (celle) billede af de Purdue-udviklede metalstifte
- Hvad er den fulde form for videnskab?
- Hvad spiste Megalodon? Alt, hvad den ville, inklusive andre rovdyr
- Hvad er et vandmolekyle, der mister hydrogenion?
- Glyphosat:hvor er det forbudt eller begrænset?
- Hvad er der i en isotop? Ganske meget
- Nintendo registrerer et ni-måneders overskud, opgraderer den årlige prognose


