Hvor mange milliliter 0,45 M HCl vil neutrilisere 25,0 ml 1,00 M KOH?
$$HCl + KOH → KCl + H_2O$$
Ud fra ligningen kan vi se, at 1 mol HCl reagerer med 1 mol KOH. Derfor er antallet af mol HCl, der kræves for at neutralisere 25,0 mL 1,00 M KOH:
$$25,0 \text{ mL KOH} \times \frac{1 \text{ mmol KOH}}{1 \text{ mL KOH}} \times \frac{1 \text{ mmol HCl}}{1 \text{ mmol KOH} }} =25,0 \text{ mmol HCl}$$
Volumenet af 0,45 M HCl, der kræves for at give 25,0 mmol HCl, er:
$$25,0 \text{ mmol HCl} \times \frac{1 \text{ mL HCl}}{0,45 \text{ mmol HCl}} =55,6 \text{ mL HCl}$$
Derfor kræves 55,6 ml 0,45 M HCl for at neutralisere 25,0 ml 1,00 M KOH.
 Varme artikler
Varme artikler
-
 At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge
At gøre alkohol til nøgleingredienser til ny medicinForskere har fundet en måde at omdanne alkohol til aminosyrer, afgørende komponenter i mange lægemidler. Kredit:Unsplash Kemikere har fundet en måde at omdanne alkohol til aminosyrer, livets bygge -
 Forskere designer ny metabolisk teknologi for at åbne videnskabelige data for alleKredit:CC0 Public Domain Patienter ønsker at se deres medicinske oplysninger. Forskere vil gerne dele deres data. Nu, forskere ved Scripps Research har frigivet en ny teknologi designet til at gø
Forskere designer ny metabolisk teknologi for at åbne videnskabelige data for alleKredit:CC0 Public Domain Patienter ønsker at se deres medicinske oplysninger. Forskere vil gerne dele deres data. Nu, forskere ved Scripps Research har frigivet en ny teknologi designet til at gø -
 Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At
Omdannelse af CO2 til brugbar energiBrookhaven-forskere er afbilledet ved NSLS-II beamline 8-ID, hvor de brugte ultrastærkt røntgenlys til at se den kemiske kompleksitet af et nyt katalytisk materiale. Fra venstre mod højre ses Klaus At -
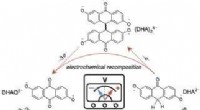 Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig
Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig
- Et jordskælv på 6,7 rammer Filippinerne:USGS
- De seneste flyulykker strider mod trenden mod sikrere flyvning
- Bæredygtigt, højtydende papirbelægningsmateriale kan reducere mikroplastikforurening
- Forskere opdager, hvordan velgørende organisationer kan øge sandsynligheden for donationer via sma…
- Inviter forbrugere til pop-up, og pop går til udgifterne – offline og online
- Hvad sker der, når du går fra lav effekt til høj magt på et mikroskop?


