Hvad er pH af ammoniumnitrat?
* Hydrolyse: Når ammoniumnitrat opløses i vand, gennemgår det hydrolyse. Dette betyder, at ammoniumionen (NH₄⁺) reagerer med vand for at producere hydroniumioner (H₃O⁺) og ammoniak (NH₃):
NH₄⁺ + H₂O ⇌ H₃O⁺ + NH₃
* ligevægt: Denne reaktion er en ligevægt, men den favoriserer dannelsen af hydroniumioner, hvilket gør opløsningen lidt sur. Tilstedeværelsen af H₃O⁺ -ioner er det, der giver opløsningen en pH -værdi mindre end 7.
Den nøjagtige pH for en ammoniumnitratopløsning afhænger af dens koncentration. En mere koncentreret opløsning vil være mere sur.
Her er en generel retningslinje:
* fortyndede løsninger: Har typisk en pH i området 5-6.
* Koncentrerede løsninger: Kan have en pH -værdi så lav som 4 eller 3.
Vigtig note: Se altid en pålidelig kilde eller udfør en pH -måling for at bestemme den nøjagtige pH for en specifik ammoniumnitratopløsning.
 Varme artikler
Varme artikler
-
 Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort
Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort -
 Forskning peger på en anden chance for afvist antibiotikakandidatKredit:University of Leeds En antibiotikakandidatforbindelse, der blev lagt på hylden i 1970erne til fordel for mere lovende lægemidler, kunne være et ekstra kig værd, ny forskning har fundet. St
Forskning peger på en anden chance for afvist antibiotikakandidatKredit:University of Leeds En antibiotikakandidatforbindelse, der blev lagt på hylden i 1970erne til fordel for mere lovende lægemidler, kunne være et ekstra kig værd, ny forskning har fundet. St -
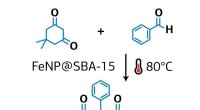 Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an
Kemiker foreslår en ny metode til grøn syntese af xanthenderivaterKredit:RUDN University En RUDN -kemiker har foreslået en ny metode til syntese af xanthenderivater, som bruges som grundlag for fremstilling af lægemidler - fra antidepressiva til antivirale og an -
 Dårligt guld kan trods alt være værdifuldtDette billede viser et eksempel på en krystal af jernsulfid dyrket i University of Minnesota lab til ekstrem høj renhed ved hjælp af en metode kaldet kemisk damptransport. Bemærk den gyldne glans, som
Dårligt guld kan trods alt være værdifuldtDette billede viser et eksempel på en krystal af jernsulfid dyrket i University of Minnesota lab til ekstrem høj renhed ved hjælp af en metode kaldet kemisk damptransport. Bemærk den gyldne glans, som
- Giver to 12 volt 100 amp -timebatterier mig 200 timer ved 24 volt?
- Hvor meget solenergi absorberes af et panel?
- Forskere afslører hemmeligheden om, hvad der får planter til at blomstre
- NASA-teknologier reducerer flystøj betydeligt
- Hvad er oxidationstilstanden for N i salpetersyre HNO3?
- Constellations Near Orion


