Hvad sker der, når en opløsning af salpetersyre tilsættes til kaliumhydroxid?
Her er den afbalancerede kemiske ligning:
hno₃ (aq) + KOH (aq) → Kno₃ (aq) + h₂o (l)
Forklaring:
* salpetersyre (HNO₃) er en stærk syre, hvilket betyder, at den let donerer en hydrogenion (H⁺).
* kaliumhydroxid (KOH) er en stærk base, hvilket betyder, at den let accepterer en hydrogenion (H⁺).
Når disse to opløsninger er blandet, reagerer hydrogenioner fra salpetersyren med hydroxidionerne fra kaliumhydroxidet og danner vand (H₂O). De resterende ioner, kalium (K⁺) og nitrat (NO₃⁻), kombineres for at danne kaliumnitrat (Kno₃), der opløses i vandet for at skabe en opløsning.
Nøglepunkter:
* Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
* Opløsningens pH ændrer sig fra sur (HNO₃) til basisk (KOH), indtil den når en neutral pH (ca. 7), når reaktionen er afsluttet.
* Reaktionen betragtes som en dobbeltfortrængningsreaktion, hvor de positive og negative ioner af reaktanterne skifter partnere til at danne nye produkter.
Ansøgninger:
* Neutraliseringsreaktioner bruges i mange anvendelser, såsom:
* spildevandsbehandling: At neutralisere surt eller grundlæggende spildevand.
* pH -justering: At justere pH af løsninger i forskellige brancher.
* Syntese af salte: At fremstille salte som kaliumnitrat, der har forskellige anvendelser i gødning, eksplosiver og konservering af fødevarer.
 Varme artikler
Varme artikler
-
 Virkningen af stigningen i afvisning af nye lægemidlerKredit:CC0 Public Domain Antallet af nye lægemiddelansøgninger afvist af U.S. Food and Drug Administration har været stigende. Forsidehistorien om Nyheder om kemi og teknik ( C&EN ), det ugent
Virkningen af stigningen i afvisning af nye lægemidlerKredit:CC0 Public Domain Antallet af nye lægemiddelansøgninger afvist af U.S. Food and Drug Administration har været stigende. Forsidehistorien om Nyheder om kemi og teknik ( C&EN ), det ugent -
 Skovforskere udvikler innovative træbaserede materialer til 3D-printBiopastaen, der bruges til at trykke denne cylinder, består af 50 procent lignin og 50 procent cellulose. Kredit:Lisa Ebers En tyktflydende biopasta, der er nem at behandle, størkner hurtigt og er
Skovforskere udvikler innovative træbaserede materialer til 3D-printBiopastaen, der bruges til at trykke denne cylinder, består af 50 procent lignin og 50 procent cellulose. Kredit:Lisa Ebers En tyktflydende biopasta, der er nem at behandle, størkner hurtigt og er -
 En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri
En selvhelbredende, vandafvisende belægning, der er ultra holdbarEn vanddråbe hopper af en hydrofob belægning på en overflade, der er blevet brændt og slidt i NCRC den 28. marts, 2017. Kredit:Joseph Xu/Multimedia Content Producer, University of Michigan - Engineeri -
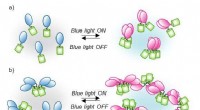 Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn
Proteinblanding under blåt lysSkema af CRY2PHR klyngemekanismen udløst af blåt lys. I dette optogenetiske system, CRY2-klynger (blå og pink) styres reversibelt af blåt lys. Hvis CRY2 er forbundet med fluorescerende proteiner (grøn
- Europas brande forværres, selvom klimamålene nås:undersøgelse
- Top 5 mest populære våben - og hvorfor
- NASAs Spitzer spionerer en perfekt sidelæns galakse
- Hvad er de tre komponenter i en cellemembran?
- Genkendelse af sygdom ved hjælp af færre data
- Ny mekanisme for radioemission i neutronstjerner frigivet


