Hvad er den molekylære formel på 284,77G Mol CCL?
* Empirisk formel: Den empiriske formel fortæller dig det enkleste forhold mellem hele nummeret mellem atomer i en forbindelse. CCL fortæller os, at der er et carbonatom for hvert kloratom.
* molekylær formel: Den molekylære formel viser det faktiske antal atomer i hvert element i et molekyle.
For at finde den molekylære formel har du brug for følgende:
1. Molmasse af den empiriske formel: Beregn den molære masse af CCL:
* Carbon (c):12,01 g/mol
* Klor (CL):35,45 g/mol
* Molær masse af CCL:12.01 + 35.45 =47,46 g/mol
2. Opdel den givne molære masse med den empiriske formel Molær masse:
* 284,77 g/mol/47,46 g/mol =6
3. Multiplicer underskrifterne i den empiriske formel med resultatet:
* Ccl * 6 =c₆cl₆
Derfor er den molekylære formel for forbindelsen med en molær masse på 284,77 g/mol og den empiriske formel CCL c₆cl₆.
Vigtig note: Den molekylære formel kan være forskellig, hvis den givne molære masse ikke er nøjagtig, eller hvis der er en fejl i den angivne empiriske formel.
Sidste artikelHvad hedder den kemiske forbindelse calciumhydrogencarbonat?
Næste artikelHvordan fungerer en fosfatreaktor?
 Varme artikler
Varme artikler
-
 Litauere udvikler en takeaway-madpakke, der er fuldstændig plastikfriKaunas borgere, forskere og virksomheder skabte en innovativ madpakke med madpakke under en fælles workshop. Kredit:KTU Takeaway mad er blevet en integreret del af vores liv. På trods af bekvemmeli
Litauere udvikler en takeaway-madpakke, der er fuldstændig plastikfriKaunas borgere, forskere og virksomheder skabte en innovativ madpakke med madpakke under en fælles workshop. Kredit:KTU Takeaway mad er blevet en integreret del af vores liv. På trods af bekvemmeli -
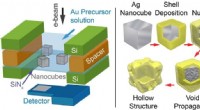 Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde
Realtidsbillede af kemiske processer(Venstre) Figur viser en skematisk af in situ LC-TEM opsætningen involverer sølv (Ag) nanokuber i en opløsning af guld (Au) ioner. (Til højre) Mekanisme, der viser den strukturelle transformation unde -
 Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri
Langvarig og præcis dosering af medicin takket være en olie-hydrogelblandingProfessor Job Boekhoven og Caren Wanzke ved det tekniske universitet i München opdagede et nyt materialesystem, der kan frigive lægemidler med en konstant frigivelseshastighed over en afstemmelig peri -
 Diætfedt interagerer med druetanniner for at påvirke vinsmagKredit:CC0 Public Domain Vinelskere erkender, at en perfekt parret vin kan få et lækkert måltid til at smage endnu bedre, men det omvendte er også sandt:Visse fødevarer kan påvirke smagen af vin
Diætfedt interagerer med druetanniner for at påvirke vinsmagKredit:CC0 Public Domain Vinelskere erkender, at en perfekt parret vin kan få et lækkert måltid til at smage endnu bedre, men det omvendte er også sandt:Visse fødevarer kan påvirke smagen af vin
- Din næste træstol kunne ankomme flad og derefter tørre til en 3D-form
- Fra sci-fi til videnskabslaboratorium:Hologrammer, du kan mærke
- Koralgenom afslører cysteinoverraskelse
- Leder du efter en ny guldmine? Vi har kortet
- Hvorfor er billegemer ikke lavet af et metal med lav densitet som magnesium?
- Når en intern kandidat mister et CEO-bud, opstår der andre muligheder


