En binding dannes gennem en svag elektrisk tiltrækning mellem hydrogenatom bundet til et elektronegativatom, såsom ilt og nitrogen, et andet elektronegativt atom?
Her er en oversigt over nøglepunkterne:
* svag elektrisk attraktion: Hydrogenbindinger er faktisk svage sammenlignet med kovalente eller ioniske bindinger. De stammer fra den ulige deling af elektroner i en kovalent binding mellem brint og et meget elektronegativt atom som ilt eller nitrogen.
* Elektronegativitet: Det elektronegative atom (ilt eller nitrogen) trækker de delte elektroner tættere på sig selv og skaber en delvis negativ ladning (Δ-) på det elektronegative atom og en delvis positiv ladning (Δ+) på hydrogenatomet.
* attraktion: Denne forskel, der er ansvarlig, skaber en attraktiv kraft mellem det delvist positive hydrogenatom og det ensomme par elektroner på et nærliggende elektronegativt atom (ofte på et andet molekyle).
Betydningen af brintbindinger:
Hydrogenbindinger er utroligt vigtige inden for biologi og kemi:
* Vand: De er ansvarlige for de unikke egenskaber ved vand, ligesom dets høje kogepunkt og evne til at opløse mange stoffer.
* Proteiner: De hjælper med at stabilisere de tredimensionelle strukturer af proteiner, som er afgørende for deres funktion.
* DNA: De holder de to DNA -tråde og danner den berømte dobbelt helix.
Fortæl mig, hvis du gerne vil udforske nogen af disse punkter mere detaljeret!
Sidste artikelHvornår dannes hydrogenbindinger?
Næste artikelHvad er ligningen, når ammoniumoxalat tilsat i calciumchloridopløsning?
 Varme artikler
Varme artikler
-
 Biostasis har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktion…DARPAs Biostasis-program har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktioner inde i celler, dermed forlænge den gyldne time for medicinsk intervention. De ønsked
Biostasis har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktion…DARPAs Biostasis-program har til formål at forhindre død efter traumatisk skade ved at bremse biokemiske reaktioner inde i celler, dermed forlænge den gyldne time for medicinsk intervention. De ønsked -
 Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga
Hvordan formen påvirker en chokoladebars krystallinske strukturChokoladeforme påvirker chokoladens krystallinske struktur. Kredit:Popovphoto/Shutterstock.com Når du nyder en chokoladebar, de fleste mennesker tænker ikke over, hvordan molekylerne i det er orga -
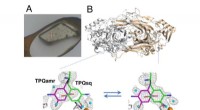 Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat
Enzymer ufrosset eventyr:I krystalproteintermodynamikIkke-kryokølet krystal monteret ved hjælp af HAG-metoden (A) og temperaturafhængig ligevægtsændring af katalytiske mellemprodukter i kobberaminoxidase (B). Kredit:Osaka University Enzymer - biokat -
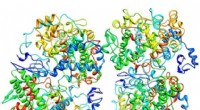 Ny sonde udviklet til at opdage et fælles mål for anti-inflammatoriske lægemidlerForskere har udviklet en sonde til at opdage et fælles mål for anti-inflammatoriske lægemidler. Billedet her:COX-2. Kredit:Wikimedia Commons Forskere har udviklet en sonde ved navn CoxFluor, der k
Ny sonde udviklet til at opdage et fælles mål for anti-inflammatoriske lægemidlerForskere har udviklet en sonde til at opdage et fælles mål for anti-inflammatoriske lægemidler. Billedet her:COX-2. Kredit:Wikimedia Commons Forskere har udviklet en sonde ved navn CoxFluor, der k
- Hvorfor ser solen større og lysere ud end andre stjerner?
- Hvorfor bruge isobutan i deodorant?
- Hvilke tilpasninger gjorde det muligt for planter at bevæge sig væk fra vandet og leve på tørt l…
- Hvilket udtryk beskriver overførslen af energi mellem objekter, der har forskellige gennemsnitlig…
- Hvad er forskellen mellem teorien om organisk evolution og den særlige skabelse?
- Hvilket element er mest reaktivt med svovl?


