Hvad er ligningen for kogende vand?
* kogning er en kompleks proces: Det involverer flere faktorer som varmeoverførsel, tryk og ændringer i stoftilstanden.
* Det er en faseændring: Vandovergange fra væske til gas, der kræver en bestemt mængde energi.
* Flere ligninger er involveret: Forskellige ligninger bruges til at beskrive specifikke aspekter af processen, som:
* Varmeoverførsel: Q =MCΔT (hvor q er varmeenergi, m er masse, c er specifik varme, og ΔT er temperaturændringen).
* Latent fordampningsvarme: Q =ml (hvor L er den latente fordampningsvarme).
* damptryk: Clausius-clapeyron-ligning bruges til at relatere damptrykket til temperaturen.
I stedet for en enkelt ligning kan du tænke på processen med at koge vand som følger:
1. varmeindgang: Du tilsætter varme til vandet og øger dens indre energi.
2. Temperaturstigning: Vandets temperatur øges, indtil det når sit kogepunkt (100 ° C ved standardtrykket).
3. faseændring: På kogepunktet bryder den tilsatte varmeenergi bindingerne mellem vandmolekyler, hvilket giver dem mulighed for at flygte som damp (vanddamp).
4. Fortsat opvarmning: Mere varme kræves for yderligere at øge temperaturen på dampen.
For at forenkle kan du sige, at den vigtigste tilstand til kogning er:
* når kogepunktet: Dette er, når vandets damptryk er lig med det omgivende atmosfæriske tryk.
Konklusion: Selvom der ikke er en ligning for "kogende vand", styres processen af principperne for varmeoverførsel, faseændring og damptryk.
Sidste artikelEr ammoniumion et reducerende eller oxidationsmiddel?
Næste artikelHvad bevæger natriumioner sig mod i en vandig opløsning?
 Varme artikler
Varme artikler
-
 Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me
Acetone plus lys skaber et grønt jetbrændstoftilsætningsstofStartende med acetone afledt af planter, forskere ved Los Alamos omdanner dette simple molekyle til jetbrændstof ved hjælp af en ny proces, der bruger lys. Dette har potentiale til at blive blandet me -
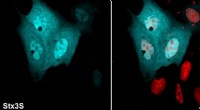 Klasse af proteiner involveret i essentielle cellefunktioner har en uventet rolle, opdager forskereOpløseligt syntaksin 3S (Stx3S) er farvet cyan, og kerner farves med rødt. Kredit:University of California - Santa Barbara I 2013 Nobelprisen i fysiologi eller medicin blev tildelt tre videnskabsm
Klasse af proteiner involveret i essentielle cellefunktioner har en uventet rolle, opdager forskereOpløseligt syntaksin 3S (Stx3S) er farvet cyan, og kerner farves med rødt. Kredit:University of California - Santa Barbara I 2013 Nobelprisen i fysiologi eller medicin blev tildelt tre videnskabsm -
 En ny guldalder for elektronik?Samariumsulfid doteret med forskellige sjældne jordarters grundstoffer krymper, når temperaturen stiger fra omkring minus 175°C til omkring 40-60°C. Her er vist den relative lineære krympning i forhol
En ny guldalder for elektronik?Samariumsulfid doteret med forskellige sjældne jordarters grundstoffer krymper, når temperaturen stiger fra omkring minus 175°C til omkring 40-60°C. Her er vist den relative lineære krympning i forhol -
 En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation
En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation
- Opløses klippesalt i vand?
- Hvad er basisenheden på et protein?
- Hvorfor følger materien en cirkulær vej, mens energi flyder på lineær måde i biosfæren?
- Hvilken kraft bremser ting, der bevæger sig, selvom luften?
- Tektoniske plader, der bevæger sig fra hinanden, er sandsynligvis sammen?
- Europas industrielle luftforurening koster hundredvis af milliarder:rapporter


