Hvorfor er NaCl ionisk forbindelse, mens chlorgas kovalent forbindelse?
ioniske forbindelser:
* dannelse: Ioniske forbindelser dannes, når et metal (som natrium, Na) mister elektroner for at blive en positivt ladet ion (kation), og en ikke -metal (som chlor, CL) får elektroner til at blive en negativt ladet ion (anion). Den elektrostatiske tiltrækning mellem de modsatte ladede ioner holder forbindelsen sammen.
* NaCl: Natrium (NA) mister let en elektron for at opnå en stabil elektronkonfiguration og bliver Na⁺. Chlor (CL) får let en elektron for at opnå en stabil elektronkonfiguration og bliver Cl⁻. Disse modsatte ladede ioner tiltrækker stærkt og danner den ioniske forbindelse natriumchlorid (NaCI).
kovalente forbindelser:
* dannelse: Kovalente forbindelser dannes, når to ikke -metaller deler elektroner for at opnå en stabil elektronkonfiguration.
* cl₂: Klor er en ikke -metal. I klorgas (CL₂) har to kloratomer hver syv valenselektroner. For at opnå stabilitet deler de en elektron hver og danner en kovalent binding.
Nøgleforskelle:
* Elektronegativitet: Metaller har lav elektronegativitet (tiltrækning for elektroner), mens ikke -metaller har høj elektronegativitet. I ioniske forbindelser er forskellen i elektronegativitet stor, hvilket fører til en komplet overførsel af elektroner. I kovalente forbindelser er elektronegativitetsforskellen mindre, hvilket resulterer i elektrondeling.
* obligationstype: Ioniske forbindelser holdes sammen af elektrostatisk tiltrækning mellem ioner. Kovalente forbindelser holdes sammen ved deling af elektronpar.
* egenskaber: Ioniske forbindelser har en tendens til at have høje smeltepunkter, høje kogepunkter og er ofte opløselige i vand. Kovalente forbindelser har generelt lavere smeltepunkter og kogepunkter og er ofte uopløselige i vand.
Kortfattet: Forskellen i bindingstype mellem NaCl og Cl₂ stammer fra elektronegativitetsforskellene mellem de involverede elementer. NaCl involverer et metal (natrium) og en ikke -metal (klor), der fører til ionisk binding. Cl₂ involverer to ikke -metaller (klor), hvilket fører til kovalent binding.
 Varme artikler
Varme artikler
-
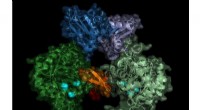 Forskerhold finder mulig ny tilgang til sovesygemedicinStruktur af parasittens IMP-dehydrogenase. Det aktive enzym danner par (dimerer), switch-området (Bateman-regionen) vises i blå nuancer. Kredit:Lübeck Universitet/DESY, Lars Redecke Ved hjælp af u
Forskerhold finder mulig ny tilgang til sovesygemedicinStruktur af parasittens IMP-dehydrogenase. Det aktive enzym danner par (dimerer), switch-området (Bateman-regionen) vises i blå nuancer. Kredit:Lübeck Universitet/DESY, Lars Redecke Ved hjælp af u -
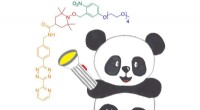 En ny proteinspin-mærkningsteknikDet nye fotoaktiverbare nitroxid til DAinv reaktionsspinmærke for proteiner, PanDA. Det kan ligeres til proteiner gennem en DAinv cycloaddition til genetisk kodede ikke-kanoniske aminosyrer. Kredit:An
En ny proteinspin-mærkningsteknikDet nye fotoaktiverbare nitroxid til DAinv reaktionsspinmærke for proteiner, PanDA. Det kan ligeres til proteiner gennem en DAinv cycloaddition til genetisk kodede ikke-kanoniske aminosyrer. Kredit:An -
 Ultrahurtige lasere sonderer undvigende kemi ved væske-væske-grænsefladenForskere ved Oak Ridge National Laboratory kaster nyt lys over undvigende kemiske processer ved væske-væske grænsefladen under opløsningsmiddelekstraktion af kobolt, vist i mørkeblå. Kredit:Michelle L
Ultrahurtige lasere sonderer undvigende kemi ved væske-væske-grænsefladenForskere ved Oak Ridge National Laboratory kaster nyt lys over undvigende kemiske processer ved væske-væske grænsefladen under opløsningsmiddelekstraktion af kobolt, vist i mørkeblå. Kredit:Michelle L -
 Genoplivende kvasikrystaller:Fund gør et eksotisk materiale kommercielt levedygtigtKredit:CC0 Public Domain En klasse af materialer, der engang så ud, som om den kunne revolutionere alt fra solceller til stegepander - men faldt i unåde i begyndelsen af 2000erne - kunne være kl
Genoplivende kvasikrystaller:Fund gør et eksotisk materiale kommercielt levedygtigtKredit:CC0 Public Domain En klasse af materialer, der engang så ud, som om den kunne revolutionere alt fra solceller til stegepander - men faldt i unåde i begyndelsen af 2000erne - kunne være kl
- Hvilken type egenskaber er lettere at genkende fysisk eller kemisk?
- Hvad er der sket med accelerationen af et objekt, hvis du fordobler både masse og ubalanceret kra…
- De seneste tendenser til global opvarmning er ikke i overensstemmelse med meget høj klimafølsomhed
- Nye syntetiske polymerer kan føre til større afgrødeudbytter for landmænd
- Amerikansk miljøundersøgelse lanceret for Thirty Meter Telescope
- FAA forsinker igen den endelige beslutning om Georgias rumhavnstilladelse


