Er hydrogenbindinger stærke eller svage?
Her er hvorfor:
* Naturens art: Hydrogenbindinger dannes af den elektrostatiske tiltrækning mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor) og et elektronpar i det tilstødende atom. Denne attraktion er svagere end de delte elektroner i kovalente bindinger eller fuldstændig overførsel af elektroner i ioniske bindinger.
* obligationsstyrke: Hydrogenbindinger er typisk i området 1-5 kcal/mol, mens kovalente bindinger kan være 50-100 kcal/mol.
* rolle i biologiske systemer: På trods af deres svaghed spiller brintbindinger afgørende roller i biologiske systemer. De hjælper med at stabilisere strukturen af proteiner, DNA og andre molekyler, hvilket bidrager til deres funktion.
Kortfattet: Hydrogenbindinger er svagere end kovalente eller ioniske bindinger, men de er stadig vigtige i mange biologiske processer.
 Varme artikler
Varme artikler
-
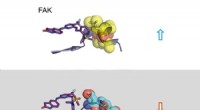 Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af -
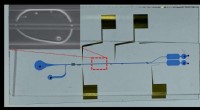 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
 Kemisk katalysator forvandler affald til skat, gør inerte CH-bindinger reaktiveVi kan ændre et billigt og rigeligt kulbrinte med begrænset anvendelighed til et værdifuldt stillads til udvikling af nye forbindelser - såsom lægemidler og andre finkemikalier, siger J.T. Fu (ovenfo
Kemisk katalysator forvandler affald til skat, gør inerte CH-bindinger reaktiveVi kan ændre et billigt og rigeligt kulbrinte med begrænset anvendelighed til et værdifuldt stillads til udvikling af nye forbindelser - såsom lægemidler og andre finkemikalier, siger J.T. Fu (ovenfo -
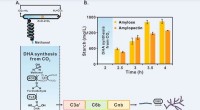 Kinesiske videnskabsmænd rapporterer om stivelsesyntese fra kuldioxidStivelsessyntese via kunstig stivelse anabolsk vej (ASAP) fra kuldioxid. Kredit:TIBCAS Kinesiske videnskabsmænd rapporterede for nylig om en de novo-rute til kunstig stivelsessyntese fra kuldioxid
Kinesiske videnskabsmænd rapporterer om stivelsesyntese fra kuldioxidStivelsessyntese via kunstig stivelse anabolsk vej (ASAP) fra kuldioxid. Kredit:TIBCAS Kinesiske videnskabsmænd rapporterede for nylig om en de novo-rute til kunstig stivelsessyntese fra kuldioxid
- Hvad er en konverter af elektrisk til lysenergi?
- Nationer forfiner matematik og naturvidenskabelige uddannelser for at holde trit med en foranderlig …
- Sådan beregnes Radius
- Hvor mange dåser i en plade?
- Konvertering af PFAS for evigt kemikalier til værdifulde forbindelser
- Hvilken form for energi bruger du, når du er en ovn?


