Har alle kemiske reaktioner brug for varme for at starte dem?
1. Lys: Fotosyntesen er et godt eksempel på en reaktion drevet af lysenergi. Planter bruger sollys til at omdanne kuldioxid og vand til glukose og ilt.
2. Elektrisk energi: Elektrolyse er en proces, hvor elektrisk energi bruges til at drive en ikke-spontan kemisk reaktion. For eksempel producerer elektrolysen af vand brint og iltgas.
3. Mekanisk energi: Slibning eller knusende faste stoffer kan give energien til at starte en reaktion. For eksempel kan den eksplosive reaktion af kaliumperchlorat med sukker udløses ved at slibe dem sammen.
4. Katalysatorer: Katalysatorer fremskynder reaktioner ved at sænke aktiveringsenergien uden at blive fortæret sig selv. For eksempel er enzymer biologiske katalysatorer, der letter utallige reaktioner i levende organismer.
5. Spontane reaktioner: Nogle reaktioner frigiver energi og fortsætter uden ekstern input. Disse er kendt som eksotermiske reaktioner, og de frigiver ofte varme som et produkt af reaktionen. Et simpelt eksempel er forbrænding af træ.
Derfor er behovet for varme ikke et universelt krav for alle kemiske reaktioner. Den energi, der kræves til at starte en reaktion, kan leveres i forskellige former, herunder lys, elektricitet, mekanisk energi, katalysatorer eller endda være iboende i selve reaktionen.
 Varme artikler
Varme artikler
-
 Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale.
Flåtprotein hjælper antibiotika med at bekæmpe MRSA super bugKredit:stock.adobe.com Et protein afledt af flåter øger effektiviteten af antibiotikabehandling af methicillin-resistente Staphylococcus aureus, eller MRSA, ifølge en undersøgelse ledet af Yale. -
 Pålideligt simulerende polyurethanskumPU -udvidelsessimulering med FOAM til fremstilling af en køler. Kredit:Fraunhofer ITWM Autostole, madrasser og isoleringsmaterialer er ofte lavet af polyurethanskum. Opskummingsprocessen for de fl
Pålideligt simulerende polyurethanskumPU -udvidelsessimulering med FOAM til fremstilling af en køler. Kredit:Fraunhofer ITWM Autostole, madrasser og isoleringsmaterialer er ofte lavet af polyurethanskum. Opskummingsprocessen for de fl -
 Afsløring af trans-fedtsyrers grimme virkning i blodetForbrug af transfedtsyrer, findes ofte i forarbejdede fødevarer, øger risikoen for hjertesygdomme og slagtilfælde. Kredit:Creative Commons Zero (CC0) licens Tohoku University forskere har fundet u
Afsløring af trans-fedtsyrers grimme virkning i blodetForbrug af transfedtsyrer, findes ofte i forarbejdede fødevarer, øger risikoen for hjertesygdomme og slagtilfælde. Kredit:Creative Commons Zero (CC0) licens Tohoku University forskere har fundet u -
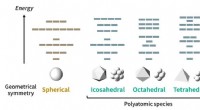 Opdagelse af periodiske tabeller for molekylerDen foreslåede model tegner sig for orbitalmønstre, der adlyder visse regler for mange typer symmetrier. Selvom en kugle har den højeste geometriske symmetri, der er ingen ægte polyatomiske arter med
Opdagelse af periodiske tabeller for molekylerDen foreslåede model tegner sig for orbitalmønstre, der adlyder visse regler for mange typer symmetrier. Selvom en kugle har den højeste geometriske symmetri, der er ingen ægte polyatomiske arter med
- Hvad er de to planeter i samme størrelse?
- Hvorfor betragtes farynxen som en del af fordøjelsessystemet, selvom det ikke fordøjer eller absor…
- Har Kepler 186F åndbar luft?
- Racemæssig skævhed pletter kvarterer – og beboere, forskning afslører
- Hvilken ion vil mest sandsynligt danne i forbindelser fra magnesium?
- Hvorfor er mobiltelefoner magnetiske?


