Hvad sker der under en kemisk reaktion?
1. Reaktanter: Startmaterialerne i en kemisk reaktion kaldes reaktanter. Det er de stoffer, der vil blive transformeret.
2. Bonds Break: Energi kræves for at bryde de kemiske bindinger, der holder atomerne sammen i reaktanterne. Denne energi kan komme fra varme, lys eller andre former for energi.
3. Formular til obligationer: Når de gamle obligationer går i stykker, dannes nye bindinger mellem atomerne og skaber nye molekyler. Denne proces frigiver energi, der kan være i form af varme, lys eller andre former for energi.
4. Produkter: De nye stoffer dannet i en kemisk reaktion kaldes produkter. De har en anden kemisk sammensætning og ofte forskellige egenskaber end reaktanterne.
Nøglekoncepter:
* bevarelse af masse: Den samlede masse af reaktanterne før en kemisk reaktion er lig med den samlede masse af produkterne efter reaktionen. Atomer oprettes ikke eller ødelægges, de omarrangeres simpelthen.
* Energiændringer: Kemiske reaktioner involverer enten frigivelsen (eksotermisk) eller absorption (endotermisk) af energi.
* reaktionshastigheder: Den hastighed, hvormed en reaktion opstår, kan påvirkes af faktorer som temperatur, koncentration og tilstedeværelsen af katalysatorer.
Eksempel:
Reaktionen mellem brintgas (H2) og iltgas (O2) til dannelse af vand (H2O) er et klassisk eksempel:
* reaktanter: Brint (H2) og ilt (O2)
* obligationer Break: Bindingerne i brint- og iltmolekyler bryder.
* obligationer form: Nye bindinger dannes mellem brint- og iltatomer, hvilket skaber vandmolekyler (H2O).
* Produkter: Vand (H2O)
I et nøddeskal: Kemiske reaktioner handler om omarrangering af atomer og molekyler for at skabe nye stoffer med forskellige egenskaber. Denne proces involverer at bryde gamle obligationer, danne nye obligationer og frigive eller absorbere energi.
Sidste artikelHvilken gruppe hører iltnitrogen og svovl?
Næste artikelHvilken gas produceres, når et metal reagerer med syre?
 Varme artikler
Varme artikler
-
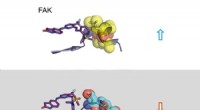 Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af
Når aktivt stof og målprotein omfavner hinandenØverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af -
 Mere end H2O:Teknologi måler samtidig 71 grundstoffer i vand, andre væskerEn ny metode til samtidig måling af 71 uorganiske grundstoffer i væsker - inklusive vand, drikkevarer, og biologiske væsker - gør elementtest meget hurtigere, mere effektivt, og mere omfattende end ti
Mere end H2O:Teknologi måler samtidig 71 grundstoffer i vand, andre væskerEn ny metode til samtidig måling af 71 uorganiske grundstoffer i væsker - inklusive vand, drikkevarer, og biologiske væsker - gør elementtest meget hurtigere, mere effektivt, og mere omfattende end ti -
 Supermagneter fra en 3-D printerForskerholdet er nu lykkedes med at fremstille miniaturiserede supermagneter ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Magnetiske materialer er en vigtig bestanddel af mekatroniske
Supermagneter fra en 3-D printerForskerholdet er nu lykkedes med at fremstille miniaturiserede supermagneter ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Magnetiske materialer er en vigtig bestanddel af mekatroniske -
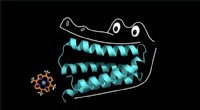 Labfremstillede proteinkugle co-faktor som en stor ol gatorDet syntetiske protein klemmer sig fast på porphyrinen som en alligators kæber. Kredit:Nicholas Polizzi Proteiner har magt til at turbolade biokemiske reaktioner inde i kroppen. Uden hjælp af pro
Labfremstillede proteinkugle co-faktor som en stor ol gatorDet syntetiske protein klemmer sig fast på porphyrinen som en alligators kæber. Kredit:Nicholas Polizzi Proteiner har magt til at turbolade biokemiske reaktioner inde i kroppen. Uden hjælp af pro
- Pig Zombies Are Here - Sort Of
- Der er kun 15 mulige femkantede fliser, forskning beviser
- Hvordan fluer vender rundt ved take-off fra en omvendt position
- Det universelle opdelingskriterium for varmt, flydende lava?
- Elektron spin ændringer som en generel mekanisme for anæstesi?
- Hvilket kongerige prokaryoter?


