Hvorfor når ammoniakgas bobles i vand, har opløsningen en så høj pH -værdi?
1. Ammoniak er en svag base:
* Ammoniak (NH₃) er en svag base. Dette betyder, at det kun delvist ioniserer (dissocieres) i vand, hvilket frigiver en lille mængde hydroxidioner (OH⁻).
* Den kemiske ligning for denne reaktion er:
NH₃ (aq) + H₂O (L) ⇌ NH₄⁺ (aq) + OH⁻ (aq)
2. Hydroxidioner øger pH:
* Hydroxidionerne (OH⁻) er ansvarlige for opløsningens alkalinitet (grundlæggende natur). Jo højere koncentration af OH⁻ioner er, jo højere er pH -værdien.
3. Ligevægt og begrænset ionisering:
* Mens ammoniak reagerer med vand, er reaktionen reversibel. Dette betyder, at det når en ligevægt, hvor nogle ammoniak forbliver uudskilt, og nogle omdannes til ammoniumioner (NH₄⁺) og hydroxidioner (OH⁻).
* Da ammoniak er en svag base, favoriserer ligevægten den uudskillede form for ammoniak. Dette betyder, at koncentrationen af OH⁻ioner er relativt lav sammenlignet med en stærk base, men stadig høj nok til at betydeligt hæve pH.
Kortfattet:
* Ammoniak er en svag base, hvilket betyder, at den kun delvis ioniserer i vand, hvilket frigiver en begrænset mængde hydroxidioner (OH⁻).
* Tilstedeværelsen af disse hydroxidioner øger opløsningens pH -værdi, hvilket gør det grundlæggende.
* Jo højere koncentration af ammoniak, jo højere er koncentrationen af OH⁻ioner, og jo højere pH -værdi.
 Varme artikler
Varme artikler
-
 Hvorfor cannabis lugter skunkyKredit:CC0 Public Domain Efterhånden som cannabis legaliseres på flere områder, er det blevet mere og mere populært som lægemiddel og rekreativt stof. Denne plante producerer en skarp, skunk-lignen
Hvorfor cannabis lugter skunkyKredit:CC0 Public Domain Efterhånden som cannabis legaliseres på flere områder, er det blevet mere og mere populært som lægemiddel og rekreativt stof. Denne plante producerer en skarp, skunk-lignen -
 Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h
Kemikere udvikler en bioinspireret strategi til kontrolleret syntese af polyenerLysdrevet flip af alkengeometri. Kredit:Ryan Gilmour De forekommer i naturen, er reaktive og spiller en rolle i mange biologiske processer:polyener. Det er ikke underligt, at kemikere i lang tid h -
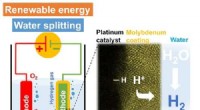 Belægning af molybdæn forbedrer effektiviteten af katalysatorer til fremstilling af brintEt højopløseligt elektronmikroskopbillede (til højre) af det elektrokatalytiske platinlag belagt med molybdæn. Platinet katalyserer hydrogenudviklingsreaktionen (til venstre) i surt medium fra protone
Belægning af molybdæn forbedrer effektiviteten af katalysatorer til fremstilling af brintEt højopløseligt elektronmikroskopbillede (til højre) af det elektrokatalytiske platinlag belagt med molybdæn. Platinet katalyserer hydrogenudviklingsreaktionen (til venstre) i surt medium fra protone -
 Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
Forskere udvikler grønne alternativer til fossile råvarerStefan Spirk vil erstatte miljøskadelige komponenter med biobaserede materialer, primært stoffer fra papir- og papirmasseindustrien. © Lunghammer – TU Graz Som en vedvarende ressource, træ rummer
- Sneboldkammer hjælper forskere med at bruge underafkølet vand til at søge efter mørkt stof
- Samfundstjeneste og betingede domme har betydelig indvirkning på gentagelse af lovovertrædelser, u…
- Hvilke energiomdannelser finder sted, når et stykke papir brændes?
- Er diamanter den hårdeste ædelsten på jorden?
- Hvordan understøttes Big Bang -teorien af observeret Doppler -skift af galakser?
- Hvilken type sten findes Diamond i?


