Ved hvilken temperatur begynder en koncentreret vandig opløsning af natriumchlorid at koge?
* kogepunkthøjde: Tilsætning af et opløst stof (som salt) til et opløsningsmiddel (som vand) øger opløsningens kogepunkt. Dette kaldes kogepunkthøjde.
* Koncentration betyder noget: Jo mere opløselig du tilføjer, jo højere er kogepunkthøjden. En koncentreret opløsning vil have et højere kogepunkt end en fortyndet opløsning.
for at bestemme kogepunktet:
1. du har brug for koncentrationen: Koncentrationen af natriumchloridopløsningen skal specificeres, normalt med hensyn til molaritet, molalitet eller procentdel efter masse.
2. Brug kogepunktets højde formel: Kogepunkthøjden beregnes ved hjælp af formlen:
ΔT =kb * m
Hvor:
* ΔT =Ændring i kogepunkt
* KB =Ebullioscopic Constant for vand (0,512 ° C/m)
* m =molalitet af opløsningen (mol opløst stof pr. kg opløsningsmiddel)
Eksempel:
Lad os sige, at du har en 1 molal (1 m) opløsning af NaCl.
* ΔT =(0,512 ° C/m) * (1 m) =0,512 ° C
Da det normale kogepunkt af rent vand er 100 ° C, ville kogepunktet for denne 1 M NaCl -opløsning være ca. 100,512 ° C.
Konklusion: Du skal kende den specifikke koncentration af natriumchloridopløsningen for at beregne dets kogepunkt.
 Varme artikler
Varme artikler
-
 Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto
Dyrkning af polymerer med forskellige længderSymbolsk repræsentation af, hvordan spredningen af et plastik kan kontrolleres ved at blande to katalysatorer (malerør). Kredit:Whitfield R et al, Chem, 2020 ETH-forskere har udviklet en ny meto -
 Lys i stedet for elektricitet:En ny slags grøn brintStrukturelle modeller af to klynger, der gør det muligt at spalte vand i O2 og H2 ved hjælp af lysenergi. Kredit:Vienna University of Technology Brint kan blive en vigtig del af vores fremtidige en
Lys i stedet for elektricitet:En ny slags grøn brintStrukturelle modeller af to klynger, der gør det muligt at spalte vand i O2 og H2 ved hjælp af lysenergi. Kredit:Vienna University of Technology Brint kan blive en vigtig del af vores fremtidige en -
 Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab
Undersøgelse viser, at tryk inducerer usædvanligt høj elektrisk ledningsevne i polyiodidDen elektroniske energi af I5- beregnet i vakuum, som funktion af δ1 og δ2. Farven angiver destabiliseringen fra den symmetriske I5-. De hvide cirkler repræsenterer poster i Cambridge Structural Datab -
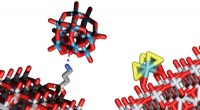
 Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv
Forskere programmerer biomaterialer med logiske porte, der frigiver terapeutika som reaktion på mil…Repræsentation af en simpel JA port. De grå og orange søjler repræsenterer hele porten, som forbinder til polymererne, der holder hydrogel sammen (sorte og lilla bølgede linjer). Porten åbnes - frigiv
- Fremstilling af bæredygtige polymerer fra duftende molekyler
- Hvornår er et symmetrisk molekyle polært?
- Hvad troede de tidlige astronomer, at jorden var kosisteret af?
- Fremkomsten af samarbejde:Team beskriver matematisk vigtigheden af samarbejde og omdømme
- En guldalder i rumalderen? Vi kunne være minedrifts -asteroider inden 2018
- T-celler bruger magt til at ødelægge kræftceller


