Hvilket har højere kogepunkturinstof eller natriumchlorid?
* ionisk binding vs. hydrogenbinding: Natriumchlorid er en ionisk forbindelse, hvilket betyder, at det danner stærke elektrostatiske interaktioner mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (CL-). Disse ioniske bindinger er meget stærke og kræver en masse energi for at bryde, hvilket fører til et højt kogepunkt.
* Urea: Urea er en kovalent forbindelse. Det danner hydrogenbindinger, som er svagere end ioniske bindinger. Mens hydrogenbindinger bidrager til uras relativt høje smeltepunkt, er de ikke så stærke som ioniske bindinger.
Kortfattet: Jo stærkere de intermolekylære kræfter, der holder et stof sammen, jo mere energi er nødvendigt for at overvinde dem og få stoffet til at koge. Natriumchlorides ioniske bindinger er meget stærkere end Ureas hydrogenbindinger, hvilket resulterer i et markant højere kogepunkt.
 Varme artikler
Varme artikler
-
 Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E
Betydningen af vand i en lovende biomarkør mod kræftEmilio J. Cocinero, medlem af UPV/EHUs Institut for Fysisk Kemi og Biofisika Institute har samarbejdet med Francisco Corzana fra University of La Rioja, og Ramón Hurtado fra ARAID Foundation. Kredit:E -
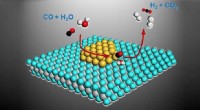 Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki
Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki -
 Hamp testlaboratorium lanceret som svar på industriens behovChristopher Perkins 89 (CAHNR) 95 MS, anbringer bakker med hamp i en tørremaskine på UConns Center for Environmental Sciences and Engineering laboratorium. Kredit:Sean Flynn/UConn Som svar på en h
Hamp testlaboratorium lanceret som svar på industriens behovChristopher Perkins 89 (CAHNR) 95 MS, anbringer bakker med hamp i en tørremaskine på UConns Center for Environmental Sciences and Engineering laboratorium. Kredit:Sean Flynn/UConn Som svar på en h -
 Screening for sygdom eller toksiner i en dråbe blodNewomics multidyseemitter. Kredit:Newomics Løftet om hurtigt og præcist at kunne screene for sygdomme eller kemiske kontaminanter i en lille dråbe blod har længe været et undvigende mål. Men viden
Screening for sygdom eller toksiner i en dråbe blodNewomics multidyseemitter. Kredit:Newomics Løftet om hurtigt og præcist at kunne screene for sygdomme eller kemiske kontaminanter i en lille dråbe blod har længe været et undvigende mål. Men viden
- Sådan sparer du energi og holder dig kølig under en hedebølge
- Hvad er hastighed, og hvordan finder du hastigheden?
- Denne transformerende rover kan udforske det hårdeste terræn
- Har en gas et bestemt volumen?
- VW-konkurrencer rapporterer, at chefen kendte til risikoen for dieselsnyd
- Orkaner eksperimenter for kids


