Hvad har fluor og klor til fælles?
* stærkt reaktive ikke -metaller: Begge er meget reaktive ikke -metaller, og danner let negative ioner (anioner) ved at få en elektron. Denne reaktivitet skyldes deres høje elektronegativitet og en stærk tendens til at opnå en stabil octet -konfiguration.
* Form diatomiske molekyler: Begge findes som diatomiske molekyler i deres elementære form (F₂ og CL₂) på grund af den stærke kovalente binding mellem to atomer af det samme element.
* Lignende kemiske egenskaber: De udviser lignende kemiske egenskaber, herunder dannelse af lignende typer forbindelser (f.eks. Halogenider).
* begge har syv valenselektroner: Begge har syv elektroner i deres yderste energiskal (valenselektroner), hvilket gør dem meget elektronegative og tilbøjelige til at danne ioniske bindinger.
* Oxidation siger: Både fluor og klor kan udvise oxidationstilstande, der spænder fra -1 til +7, men fluor findes altid i -1 -oxidationstilstand på grund af dens høje elektronegativitet.
Der findes dog nogle vigtige forskelle:
* reaktivitet: Fluor er det mest reaktive element, mens klor er mindre reaktiv.
* Kognings- og smeltepunkter: Klor har et højere smeltnings- og kogepunkt end fluor på grund af stærkere intermolekylære kræfter mellem klormolekyler.
* udseende: Klor er en gulgrøn gas ved stuetemperatur, mens fluor er en lysegul gas.
Sammenfattende deler fluor og klor betydelige ligheder som halogener, men udviser også forskellige forskelle i deres reaktivitet, fysiske egenskaber og udseende.
Sidste artikelHvad er formlen for ammonium astatid?
Næste artikelHvad er nogle af sagerne?
 Varme artikler
Varme artikler
-
 Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori
Forskere patenterer hurtige tests for kokainFIU biokemi Ph.D. studerende Haixiang Yu, kemi Ph.D. studerende Juan Canoura, og nyuddannet Obtin Alkhamis offentliggjorde en undersøgelse af FIUs patenterede kokaindetektionsteknologier. Kredit:Flori -
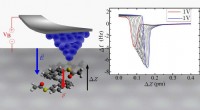 Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o
Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o -
 Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me
Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me -
 Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam
Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam
- New Delhi annoncerer planen om at bekæmpe giftig luft om vinteren
- Forskere begynder at teste lovende nyt nanomateriale til brintlagring
- Streamet musik og digitale billeder har drevet comebacket af vinyl og printede fotos
- Løjer folk mere siden fremkomsten af sociale medier og smartphones?
- Hvad kaldes lineær hastighed, når noget bevæger sig i en cirkel?
- Hvad sker der med kræfter, der bevæger sig i forskellige retning?


