Hvilken kemisk proces bruges til at få et metal fra dets oxid?
1. Reduktion:
Dette er den mest almindelige metode til opnåelse af metaller fra deres oxider. Det involverer at reagere metaloxidet med et reduktionsmiddel, der fjerner ilt fra oxidet og efterlader det rene metal.
* kulstofreduktion: Dette er vidt brugt til ekstraktion af metaller som jern, zink og tin fra deres oxider. Carbon (i form af koks eller trækul) fungerer som det reducerende middel.
* Eksempel: Fe₂o₃ (jernoxid) + 3c (carbon) → 2Fe (jern) + 3co (carbonmonoxid)
* Hydrogenreduktion: Denne metode bruges til metaller som wolfram og molybdæn. Hydrogengas fungerer som det reduktionsmiddel ved høje temperaturer.
* Eksempel: Wo₃ (wolframoxid) + 3H₂ (brint) → W (wolfram) + 3H₂o (vand)
* Elektrolytisk reduktion: Denne metode bruges til stærkt reaktive metaller som aluminium og natrium, som ikke kan reduceres med kulstof. Elektrolyse bruger en elektrisk strøm til at drive en kemisk reaktion.
* Eksempel: 2Al₂o₃ (aluminiumoxid) → 4Al (aluminium) + 3o₂ (ilt)
2. Termisk nedbrydning:
Denne metode involverer opvarmning af metaloxidet til en høj temperatur, hvilket får det til at nedbrydes i metallet og ilt. Dette bruges hovedsageligt til oxider af mindre reaktive metaller som Merkur.
* Eksempel: 2HGO (Mercury Oxide) → 2HG (Mercury) + O₂ (Oxygen)
3. Andre metoder:
* hydrometallurgi: Denne metode involverer at opløse metaloxidet i et passende opløsningsmiddel og derefter ekstrahere metallet ved hjælp af en kemisk reaktion.
* bioaching: Denne metode bruger mikroorganismer til at udtrække metaller fra deres malm.
Den specifikke proces, der bruges til et bestemt metal, afhænger af dens reaktivitet, tilgængeligheden af passende reduktionsmidler og metodens økonomiske gennemførlighed.
 Varme artikler
Varme artikler
-
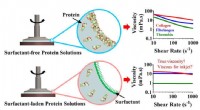 Fundning af fibrøst protein kan føre til forbedret bioprintning, vævsteknikKollagen og fibrinogen i vandige opløsninger danner et fast lag på overfladen af vand, ødelægger målinger af flowadfærd med rotationsreometere. Tilsætning af et ikke-ionisk overfladeaktivt stof i sm
Fundning af fibrøst protein kan føre til forbedret bioprintning, vævsteknikKollagen og fibrinogen i vandige opløsninger danner et fast lag på overfladen af vand, ødelægger målinger af flowadfærd med rotationsreometere. Tilsætning af et ikke-ionisk overfladeaktivt stof i sm -
 Nyt elektrodemateriale udviklet til at øge opladningskapaciteten af lithium-batterierNyt elektrodemateriale udviklet til at øge opladningskapaciteten af lithium-batterier. Kredit:Yokohama National University Lithium-batterier lover meget for fremtiden for mange applikationer, he
Nyt elektrodemateriale udviklet til at øge opladningskapaciteten af lithium-batterierNyt elektrodemateriale udviklet til at øge opladningskapaciteten af lithium-batterier. Kredit:Yokohama National University Lithium-batterier lover meget for fremtiden for mange applikationer, he -
 Præcisionseksperimenter afslører huller i van der Waals teoriKredit:University of Tsukuba Opdagelsen af grafen, med sit høje styrke-til-vægt-forhold, fleksibilitet, elektrisk ledningsevne, og evnen til at danne en uigennemtrængelig barriere, førte til en
Præcisionseksperimenter afslører huller i van der Waals teoriKredit:University of Tsukuba Opdagelsen af grafen, med sit høje styrke-til-vægt-forhold, fleksibilitet, elektrisk ledningsevne, og evnen til at danne en uigennemtrængelig barriere, førte til en -
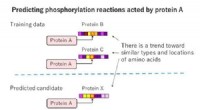 Fujitsu udvikler teknologi til at forudsige biokemiske reaktioner, afklaring af mekanismerne for gen…Figur 1:Konventionel AI-teknologi. Kredit:Fujitsu Fujitsu Laboratories Ltd., Insight Center for Data Analytics, en dataanalytisk forskningsinstitution baseret i Irland, og Fujitsu (Ireland) Limite
Fujitsu udvikler teknologi til at forudsige biokemiske reaktioner, afklaring af mekanismerne for gen…Figur 1:Konventionel AI-teknologi. Kredit:Fujitsu Fujitsu Laboratories Ltd., Insight Center for Data Analytics, en dataanalytisk forskningsinstitution baseret i Irland, og Fujitsu (Ireland) Limite
- Hvorfor giver vandig opløsning af ammoniak en skarp lugt?
- Hvad er tre måder, energi overføres fra overflade til atmosfæren?
- Mutationer? - Svar
- Undersøgelser tyder på, at racerkørere, der ligner hinanden i alder og statur, er mere tilbøjeli…
- Tilbagetrækninger af energiregulering truer fremskridt mod skadelig ozon
- Kemikere får et glimt af en reaktions flygtige overgangstilstand


