Hvordan forklarer octetreglen dannelse af en natriumion?
Octet -reglen
Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste energiniveau (Valence Shell). Denne konfiguration ligner den af ædle gasser, som er kemisk ureaktive på grund af deres fulde ydre skaller.
natriums elektronkonfiguration
* Natrium (NA) har et atomnummer på 11, hvilket betyder, at det har 11 protoner og 11 elektroner.
* Dens elektronkonfiguration er 2, 8, 1. Dette betyder, at den har en elektron i sin yderste skal.
Dannelse af natriumion
For at opnå en stabil oktet skal natrium slippe af med sin ensomme valenselektron. Dette opnås af:
1.. mister en elektron: Natrium mister sin enkelt valenselektron. Dette tab efterlader det med 10 elektroner og konfigurationen af den forrige ædle gas, neon (2, 8).
2. positiv opladning: At miste et negativt ladet elektron forlader natriumatomet med endnu en proton end elektroner. Dette resulterer i en nettopositiv opladning på +1.
3. natriumion: Det resulterende positivt ladede natriumatom er nu en natriumion (Na+).
resume
Natrium danner en positiv ion (Na+) ved at miste sin enkelt valenselektron for at opnå en stabil oktetkonfiguration som den ædle gas neon. Denne proces er i overensstemmelse med Octet -reglen, der forklarer, hvordan atomer stræber efter stabilitet ved at vinde, miste eller dele elektroner for at opnå en fuld ydre skal.
Sidste artikelHvad er for reaktionen mellem klor og vand?
Næste artikelHvor mange atomer er der i H2PO3?
 Varme artikler
Varme artikler
-
 Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle
Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle -
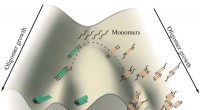 Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt
Tumbleweeds eller fibriller:Tau-proteiner skal vælgeEt skema viser væksten af tau-oligomerer impliceret i Alzheimers og Picks sygdomme. Monomerer af tau har tendens til at aggregere langs to kanaler, den ene fører til fibriller, der danner sammenfilt -
 Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af
Forskere opdager en ny fase i blokcopolymererKunstnerens koncept, der skildrer blokpolymerer pakket sammen til dannelse, I dette tilfælde, en ny fase af diblok-copolymer. Kredit:Brian Long Alt stof består af en eller flere faser - områder af -
 Udvikling af enzymer til at omdanne planteaffald til bæredygtige produkterDet nyudviklede enzym. Kredit:University of Portsmouth En ny familie af enzymer er blevet konstrueret til at udføre et af de vigtigste trin i omdannelsen af planteaffald til bæredygtige og højvæ
Udvikling af enzymer til at omdanne planteaffald til bæredygtige produkterDet nyudviklede enzym. Kredit:University of Portsmouth En ny familie af enzymer er blevet konstrueret til at udføre et af de vigtigste trin i omdannelsen af planteaffald til bæredygtige og højvæ
- USA siger, at lækkende atomaffaldskuppel er sikker; Marshalløernes ledere tror ikke på det
- Forstå hvad der sker inde i flydende dråber
- Anti-robocall lovforslag sandsynligvis som House, Senatet opnår kompromis
- Mars er stadig en aktiv verden - her er et jordskred i Nili Fossae
- Japans rumfartsagentur siger, at testflyvning for en ny flagskibsraket er omlagt til lørdag
- Har fugle en god lugtesans?


