Når natrium og klor danner en ionisk binding, erhverver begge ioner elektronkonfigurationen af en?
Her er hvorfor:
* natrium (NA): Natrium har en valenselektron i sin yderste skal. Ved at miste dette elektron bliver det en positivt ladet natriumion (Na+) med en fuld ydre skal af 2 elektroner, hvilket opnår den samme elektronkonfiguration som neon (NE).
* klor (Cl): Klor har syv valenselektroner. Det får en elektron til at afslutte sin yderste skal og blive en negativt ladet chloridion (CL-) med en fuld ydre skal af 8 elektroner og opnå den samme elektronkonfiguration som Argon (AR).
Derfor opnår begge ioner den stabile elektronkonfiguration af en ædel gas, hvilket gør den ioniske binding gunstig. Dette er en almindelig drivkraft bag ionisk binding, da atomer stræber efter at opnå de stabile elektronkonfigurationer af ædelgasser.
 Varme artikler
Varme artikler
-
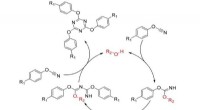 Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym
Kemikere tilbyder et nyt kig på polymerer til rumindustrienMekanisme for cyklotrimerisering af cyanatestere. Kredit:Kazan Federal University Medarbejdere ved Institut for Fysisk Kemi ved Kazan Federal University har fundet ud af, at mekanismerne til polym -
 Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe
Ny katalysator til fremstilling af brændstof fra skifergasSTM-billeddannelse af reaktionsmellemprodukter på Cu(111)- og Pt/Cu SAA-overflader. Kredit:Sykes Metan i skifergas kan omdannes til kulbrintebrændstoffer ved hjælp af en innovativ platin- og kobbe -
 Ny proces gør bionedbrydeligt plastik virkelig komposterbartEn modificeret plast (til venstre) nedbrydes efter kun tre dage i standardkompost (højre) og helt efter to uger. Kredit:Christopher DelRe, UC Berkeley Bionedbrydeligt plast er blevet annonceret so
Ny proces gør bionedbrydeligt plastik virkelig komposterbartEn modificeret plast (til venstre) nedbrydes efter kun tre dage i standardkompost (højre) og helt efter to uger. Kredit:Christopher DelRe, UC Berkeley Bionedbrydeligt plast er blevet annonceret so -
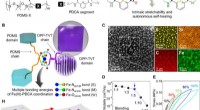 Strækbar, selvhelbredende og halvledende polymerfilm til elektronisk hud (e-skin)Design og karakterisering af belastningsfølsomme, strækbar, og selvhelbredende halvledende film. (A) Kemisk struktur af DPP halvledende polymer, PDMS, og PDCA-del introduceret i begge polymerskeletter
Strækbar, selvhelbredende og halvledende polymerfilm til elektronisk hud (e-skin)Design og karakterisering af belastningsfølsomme, strækbar, og selvhelbredende halvledende film. (A) Kemisk struktur af DPP halvledende polymer, PDMS, og PDCA-del introduceret i begge polymerskeletter
- Hvad er den ædle gaskerne -konfiguration af Rubidium?
- Jordskælv beskadiger veje, mens aske spyr fra vulkanen Hawaii
- Gør hundefoder mere lækker ved at analysere aromaer
- Hvorfor har alfa -partikel højere ionizaion -energi end beta -partikel?
- Stivelse kan erstatte almindelig plast i fødevareemballage
- Hvilke to udtryk bruges til at beskrive luftmasser?


