Hvorfor tilsættes ammoniakopløsning under forberedelsen af EDTA -løsningen?
* EDTA som chelateringsagent: EDTA (ethylendiaminetetraeddikesyre) er et kraftfuldt chelateringsmiddel, hvilket betyder, at det kan binde til metalioner og danne stabile komplekser. Denne evne er vigtig i forskellige applikationer, såsom:
* Vandbehandling: Fjernelse af tungmetaller fra vandet.
* Analytisk kemi: Titrering af metalioner til kvantitativ analyse.
* farmaceutiske stoffer: Stabilisering af metalholdige medicin.
* EDTA's PH -afhængighed: Edta's chelateringsevne er stærkt påvirket af pH. Under sure forhold findes EDTA primært i sin protonerede form (H4Y), som er en svagere chelator. Når pH øges, deprotonerer EDTA og danner de anioniske former (H3Y-, H2Y2-, HY3- og Y4-), som er meget stærkere chelateringsmidler.
* Ammoniakens rolle: Ammoniak er en svag base. Tilsætning af ammoniakopløsning til EDTA -opløsning hæver pH og favoriserer dannelsen af de deprotonerede, stærkt chelerende former for EDTA. Dette øger EDTAs effektivitet i binding af metalioner.
Kortfattet: Ammoniakopløsning føjes til EDTA -løsning til:
* maksimere EDTAs chelateringskapacitet: Ved at øge pH fremmer ammoniak dannelsen af EDTAs stærkt reaktive anioniske former.
* Sørg for optimal ydelse: Den krævede specifikke pH vil afhænge af applikationen, men ammoniak hjælper med at opnå den ønskede pH til effektiv metalchelation.
Vigtig note: Mængden af tilsat ammoniakopløsning skal kontrolleres omhyggeligt for at nå den ønskede pH til den specifikke anvendelse. Overdreven ammoniak kan påvirke opløsningens stabilitet og ydeevne.
Sidste artikelHvad er det enkleste rene stof på jorden?
Næste artikelHvad er den procentvise sammensætning af svovl i SO2?
 Varme artikler
Varme artikler
-
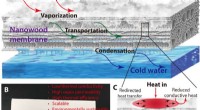 Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f
Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f -
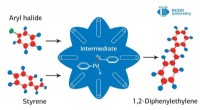 Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete
Kemiker udvikler blomsterlignende katalysatorer fra grafenKredit:RUDN University En RUDN -kemiker og kolleger fra Iran har udviklet en ny strategi til fremstilling af hule, porøse katalysatorer til Heck -koblingsreaktionen. Disse katalysatorer er kendete -
 Opbygning af en bedre brændselscelle begynder med overfladekemiForskere kiggede dybt ind i en brændselscelles indre funktioner for at få et mere komplet billede af den katalytiske proces. Dette arbejde lover at forbedre design til mere effektive celler. Kredit:Na
Opbygning af en bedre brændselscelle begynder med overfladekemiForskere kiggede dybt ind i en brændselscelles indre funktioner for at få et mere komplet billede af den katalytiske proces. Dette arbejde lover at forbedre design til mere effektive celler. Kredit:Na -
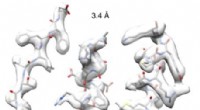 Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town
Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town


