Hvad er opløselige hydroxider?
opløselige hydroxider:en hurtig guide
opløselige hydroxider er kemiske forbindelser dannet af en metalkation (positivt ladet ion) og hydroxidanionen (OH⁻). Den vigtigste egenskab er deres evne til at opløses i vand og danne en alkalisk (grundlæggende) opløsning.
Generelle egenskaber:
* metalhydroxider: De består af en metalkation og hydroxidanion.
* alkaliske løsninger: Når de opløses i vand, frigiver de hydroxidioner (OH⁻), øger pH og gør opløsningen grundlæggende.
* opløselighed: De er let opløselige i vand.
Almindelige eksempler:
* gruppe 1 hydroxider (alkalimetaller): Dette er de mest opløselige hydroxider. Eksempler inkluderer:
* Lithiumhydroxid (LioH)
* Natriumhydroxid (NaOH) - almindeligt kendt som lut
* Kaliumhydroxid (KOH)
* gruppe 2 hydroxider (alkaliske jordmetaller): Disse er generelt mindre opløselige end gruppe 1 -hydroxider, men nogle betragtes stadig som opløselige. Eksempler inkluderer:
* Bariumhydroxid (BA (OH) ₂)
* Strontiumhydroxid (SR (OH) ₂)
* Calciumhydroxid (Ca (OH) ₂) - Også kendt som slaket kalk
Vigtige noter:
* opløselighed er relativ: Nogle hydroxider kan have begrænset opløselighed, hvilket betyder, at de kun opløses i en lille grad i vand.
* Andre faktorer, der påvirker opløselighed: Temperatur, tryk og tilstedeværelsen af andre ioner kan påvirke opløseligheden af hydroxider.
Ansøgninger:
Opløselige hydroxider har adskillige anvendelser, herunder:
* Kemisk industri: Brugt til produktion af sæber, vaskemidler, papir og forskellige kemikalier.
* Vandbehandling: Brugt til neutralisering af surt vand og fjernelse af tungmetaller.
* fødevareindustri: Brugt til fødevareforarbejdning og konservering.
* Byggeri: Brugt i cementproduktion og konkrete blandinger.
At forstå begrebet opløselige hydroxider er afgørende for forskellige områder, herunder kemi, miljøvidenskab og teknik.
Sidste artikelHvad er den korrekte kemiske formel for natriumsulfat?
Næste artikelFind massen på 0,89 mol cacl2?
 Varme artikler
Varme artikler
-
 Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer
Grønt vandrensningssystem fungerer uden tungmetaller eller ætsende kemikalierDette billede viser en koncentrator, hvor prøver blev placeret. Kredit:Dan Wang Forskere ved Institute of Process Engineering (IPE) ved det kinesiske videnskabsakademi i Beijing og Yangzhou Univer -
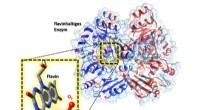 Flavins har en praktisk hjælper i lommenI det aktive center af enzymet er en flavin-cofaktor. I udvidelsen kan vi se, at nær det, ilt (O 2 ) er bundet -- hvilket gør det muligt for flavinen at blive aktiveret. Kredit:Robin Teufel, Raspudi
Flavins har en praktisk hjælper i lommenI det aktive center af enzymet er en flavin-cofaktor. I udvidelsen kan vi se, at nær det, ilt (O 2 ) er bundet -- hvilket gør det muligt for flavinen at blive aktiveret. Kredit:Robin Teufel, Raspudi -
 To-fugle-en-sten-strategien viser lovende i RNA-gentagende ekspansionssygdommeAlicia Angelbello og Matthew Disney, PhD, i Disney-laboratoriet på Scripps Researchs Jupiter, Florida, universitetsområde. Kredit:Scripps Research Institute En ny strategi til behandling af en ræk
To-fugle-en-sten-strategien viser lovende i RNA-gentagende ekspansionssygdommeAlicia Angelbello og Matthew Disney, PhD, i Disney-laboratoriet på Scripps Researchs Jupiter, Florida, universitetsområde. Kredit:Scripps Research Institute En ny strategi til behandling af en ræk -
 En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
En superopløsningsvisning af kemiske reaktionerDen nye metode til dataanalyse fra superopløsningsfluorescenskorrelationsmikroskopi er blevet verificeret, blandt andre, i forsøg, der efterligner det biologiske miljø. Forskere observerede små fluore
- Hvordan SARS-CoV-2 deaktiverer det menneskelige cellulære alarmsystem
- Hvordan ville en måneformørkelse se ud, hvis Jorden ikke havde nogen atmosfære?
- Ikke -toksisk, biologisk nedbrydeligt ortopædisk implantat kan give overlegen støtte til beskadige…
- En undersøgelse advarer om den økologiske indvirkning forårsaget af sedimentakkumulering i flodlø…
- Hvad er jordtypen for Niagara Falls?
- Kostændring – en løsning til at reducere vandforbruget?


