Hvorfor er CL2 mindre opløselig end HCL?
* Polaritet: HCL er et polært molekyle. Hydrogenatomet har en delvis positiv ladning (Δ+), og chloratomet har en delvis negativ ladning (Δ-). Denne polaritet giver HCI mulighed for at danne hydrogenbindinger med vandmolekyler, som også er polære.
* ikke -polaritet: Cl₂ er et ikke -polært molekyle. Begge kloratomer har den samme elektronegativitet, så elektronerne deles lige, hvilket resulterer i ingen overordnet ladningsadskillelse.
* Intermolekylære kræfter: Vand er et polært opløsningsmiddel og opløser let polære stoffer. Den stærke hydrogenbinding mellem vandmolekyler og HCL -molekyler letter opløsningen. Ikke -polære stoffer som Cl₂ kan ikke danne brintbindinger med vand og er således mindre opløselige.
* Hydrogenbinding: Hydrogenbindingen mellem HCI og vandmolekyler er en stærk attraktiv kraft, der forbedrer opløselighed. Cl₂ mangler evnen til at deltage i hydrogenbinding.
Kortfattet:
Den polære karakter af HCI giver den mulighed for at interagere stærkt med vandmolekyler gennem hydrogenbinding, hvilket gør det mere opløseligt end den ikke -polære CL₂.
Sidste artikelHvad er strukturelle isomerer?
Næste artikelHvordan finder du formelvægt af en forbindelse?
 Varme artikler
Varme artikler
-
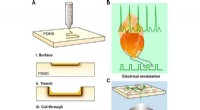 Laserskrivning af nitrogen-doteret siliciumcarbid til biologisk moduleringSkematiske illustrationer af laserskriveprocessen og dens anvendelser. (A) CO2-laser skriver et mønster på et PDMS-substrat, hvor mønsteret kan være (i) på overfladen, (ii) en skyttegrav, eller (iii)
Laserskrivning af nitrogen-doteret siliciumcarbid til biologisk moduleringSkematiske illustrationer af laserskriveprocessen og dens anvendelser. (A) CO2-laser skriver et mønster på et PDMS-substrat, hvor mønsteret kan være (i) på overfladen, (ii) en skyttegrav, eller (iii) -
 Bærbare sensorer, der registrerer gaslækagerKredit:Pohang University of Science &Technology (POSTECH) Gasulykker såsom giftig gaslækage på fabrikker, kulilte lækage af kedler, eller kvælning af giftig gas under rensning af mandehuller forts
Bærbare sensorer, der registrerer gaslækagerKredit:Pohang University of Science &Technology (POSTECH) Gasulykker såsom giftig gaslækage på fabrikker, kulilte lækage af kedler, eller kvælning af giftig gas under rensning af mandehuller forts -
 En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap
En type halvgennemsigtig polymer, der kan repareres ved stuetemperatur ved hjælp af lille trykKredit:Yu Yanagisawa Et lille team af forskere ved University of Tokyo har skabt en polymer, der kan repareres, når den brydes i to dele ved at påføre et lille tryk ved stuetemperatur. I deres pap -
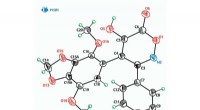 Kemikere forenkler syntesen af antitumorforbindelserKredit:RUDN Universitet En RUDN-kemiker i samarbejde med kolleger fra N.D. Zelinsky Institute of Organic Chemistry og N.K. Koltsov Institut for Udviklingsbiologi (IDB), RAS har udviklet en ny meto
Kemikere forenkler syntesen af antitumorforbindelserKredit:RUDN Universitet En RUDN-kemiker i samarbejde med kolleger fra N.D. Zelinsky Institute of Organic Chemistry og N.K. Koltsov Institut for Udviklingsbiologi (IDB), RAS har udviklet en ny meto
- Droner kunne bruges til at opdage farlige sommerfuglelandminer i post-konflikt regioner
- Hvad er måleenheden for Triple Beam Balance?
- Sådan fungerer menneskelig migration
- 2023-24 El Niño vil sandsynligvis forårsage rekordhøje gennemsnitstemperaturer i nogle områder
- Hvordan adskiller hastighed og hastighed sig?
- Diskriminerende diæter af kødspisende dinosaurer


